10-те вида химически връзки (обяснени с примери)
Химичните връзки са сили, които държат атомите заедно за да образуват молекулите. Има три вида връзки между атомите:
- Метална връзка.
- Йонна връзка.
- Ковалентна връзка: неполярна, полярна, проста, двойна, тройна, дативна.
Благодарение на тези връзки се образуват всички съединения, които съществуват в природата. Съществуват и сили, които държат молекулите заедно, известни като междумолекулни връзки, като:
- Водородни връзки или мостове.
- Дипол-диполни сили.
След това обясняваме всяка от тези връзки.
| Видове химически връзки | Характеристика | Примери | |
|---|---|---|---|
| Метал | Металните йони се носят в море от движещи се електрони. | Метални елементи: натрий, барий, сребро, желязо, мед. | |
| Йонийски | Прехвърляне на електрони от един атом в друг. | Na натриев хлорид+Cl- | |
| Ковалентен | Неполярна | Споделяйте електроните по равно между два атома. | Молекулен водород H-H или H2 |
| Полярен | Споделяйте електрони неравномерно между два атома. | Водна молекула Н2ИЛИ | |
| Просто | Споделете чифт електрони. | Хлорна молекула Cl2 Cl-Cl | |
| Двойна | Споделете две двойки електрони. | Кислородна молекула O2 O = O | |
| Тройна | Споделете три двойки електрони. | Азотна молекула N≣N или N2 | |
| Дативен | Само един от атомите споделя електроните. | Връзка между азот и бор в съединението амоняк-бор трифлуорид. | |
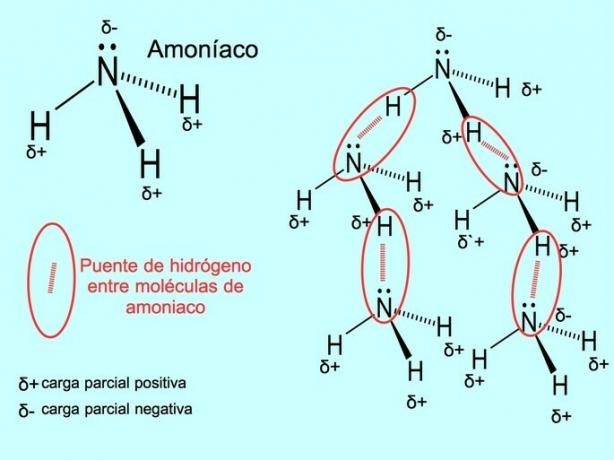
| Междумолекулни сили | Водороден мост | Водородите в една молекула се привличат към електроотрицателните атоми на друга молекула. | Водородните връзки между водорода в една молекула на водата с кислорода в друга молекула на водата. |
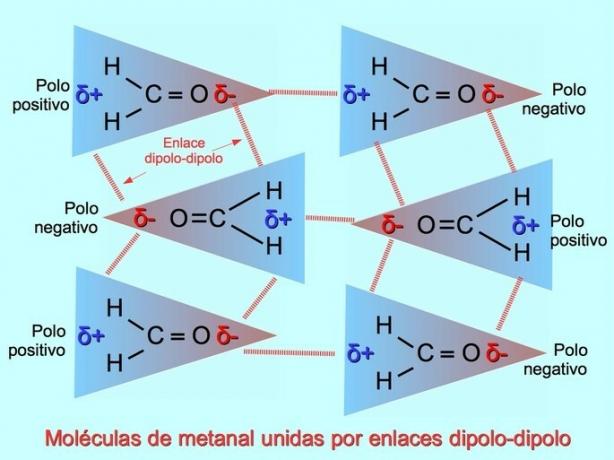
| Дипол-дипол | Молекулите с два електрически полюса привличат противоположните полюси на други молекули. | Взаимодействия между метаналните молекули Н2C = O |
Метална връзка
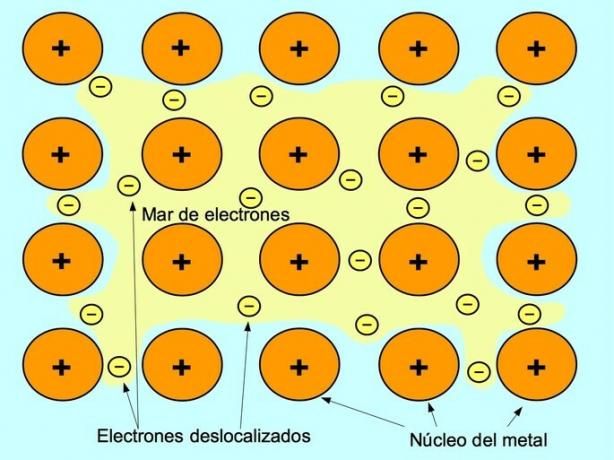
Металната връзка е силата на привличане между положителните йони на металните елементи и отрицателните електрони, които се движат свободно между йоните. Металните атоми са плътно опаковани, това позволява на електроните да се движат в решетката на атомите.
В металите валентните електрони се освобождават от първоначалния си атом и образуват "море" от електрони, което плава около цялата метална структура. Това кара металните атоми да се трансформират в положително заредени метални йони, които се събират заедно.
Металната връзка се установява между метални елементи като натрий Na, барий Ba, калций Ca, магнезий Mg, злато Au, сребро Ag и алуминий Al.
Йонна връзка
Йонната връзка е силата, която свързва метален елемент, като натрий или магнезий, с неметален елемент, като хлор или сяра. Металът губи електрони и се превръща в позитивен метален йон, наречен катион. Тези електрони преминават към неметалния елемент и той се трансформира в отрицателно зареден йон, наречен анион.
Катионите и анионите се комбинират и образуват триизмерна мрежа, която се поддържа от силите на електростатичното привличане между йоните с различни заряди. Тези сили образуват йонни съединения.
Земната кора е изградена главно от йонни съединения. Повечето скали, минерали и скъпоценни камъни са йонни съединения. Например:
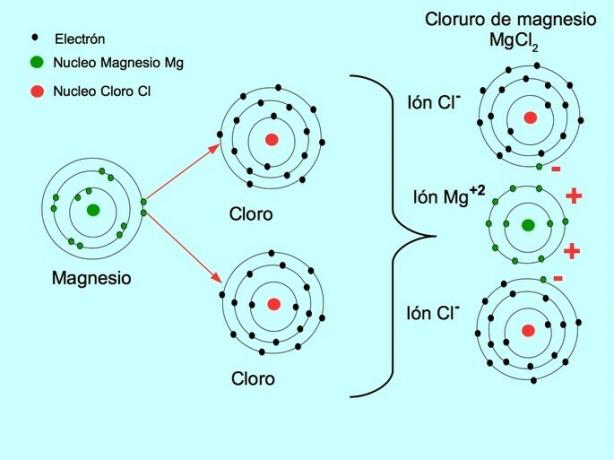
- Натриев хлорид NaCl: металният елемент е натрий, който прехвърля електрон в хлор, който е неметалният елемент.
- Магнезиев хлорид MgCl2: Магнезият Mg дарява два електрона на два хлорни атома, както е показано на фигурата по-долу:
Вижте също Разлика между катиони и аниони.
Ковалентна връзка
Ковалентната връзка се образува, когато два неметални атома споделят електрони. Тази връзка може да бъде от няколко вида в зависимост от афинитета към електроните на атомите и количеството на споделените електрони.
Неполярна ковалентна връзка
Неполярната ковалентна връзка е връзката, която се образува между два атома, където електроните се споделят по равно. Тази връзка обикновено се среща в симетрични молекули, т.е. молекули, съставени от два равни атома, като молекулата на водорода H2 и кислородната молекула O2.

Полярна ковалентна връзка
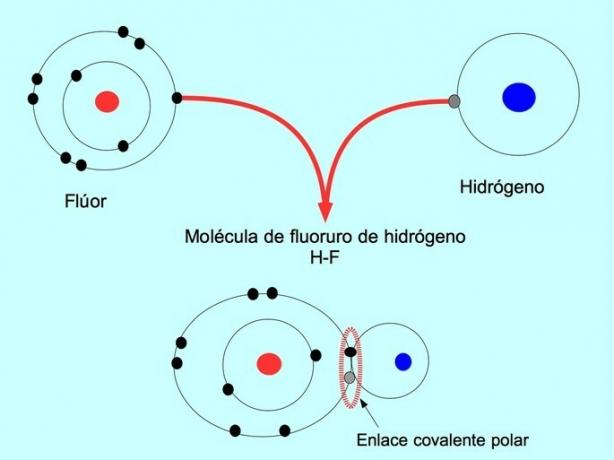
Полярната ковалентна връзка се образува, когато два атома споделят електрони, но единият от тях има по-голямо привличане за електрони. Това кара молекулата да има по-отрицателен „полюс“ с повече електрони, а противоположният полюс е по-положителен.
Молекулите с това разпределение или дисбаланс на електроните са известни като полярни. Например, във водороден флуорид HF има ковалентна връзка между водород и флуор, но флуорът има по-висока електроотрицателност, така че привлича електроните по-силно споделени.
Проста ковалентна връзка
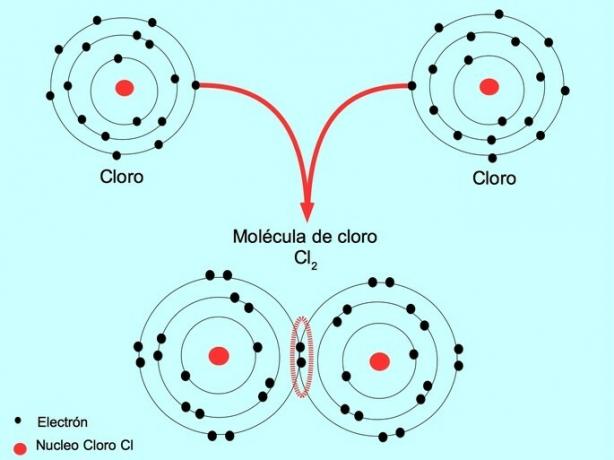
Когато два атома споделят два електрона, по един от всеки, образуваната ковалентна връзка се нарича обикновена ковалентна връзка.
Например, хлорът е атом, който има седем валентни електрона във външната си обвивка, който може да бъде запълнен с осем електрона. Хлорът може да се комбинира с друг хлор, за да образува хлорната молекула Cl2 което е много по-стабилно от хлора само.
Двойна ковалентна връзка
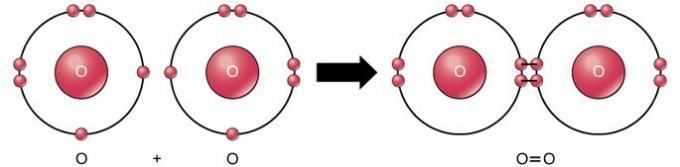
Двойната ковалентна връзка е връзката, при която четири електрона (две двойки) електрони се споделят между два атома. Например, кислородът има 6 електрона в последната си обвивка. Когато два кислорода се комбинират, четири електрона се споделят между двамата, което кара всеки да има 8 електрона в последната обвивка.
Тройна ковалентна връзка
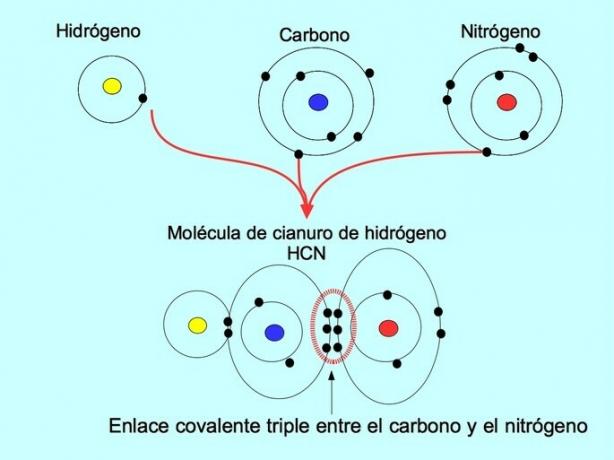
Тройната ковалентна връзка се образува, когато 6 електрона (или три двойки) се споделят между два атома. Например в молекулата на водородния цианид HCN се образува тройна връзка между въглерод и азот, както е представено на фигурата по-долу:
Координатна или дативна ковалентна връзка
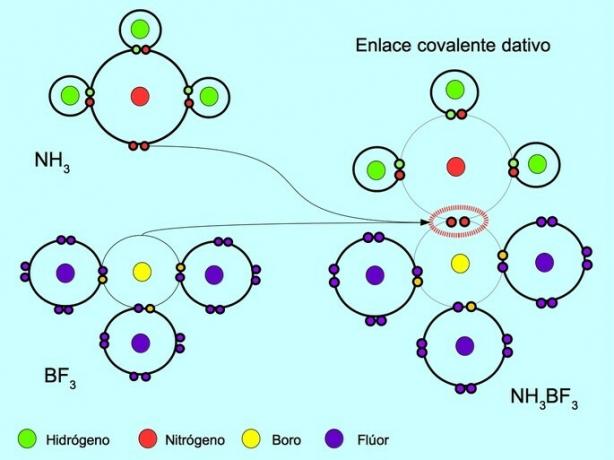
Координираната или дативна ковалентна връзка е връзката, която се образува, когато само един от атомите в връзката допринася за двойка електрони. Например, когато амоняк NH реагира3 с бор трифлуорид BF3, Азотните връзки с два електрона директно с бор, който няма налични електрони за споделяне. По този начин и азотът, и борът остават с 8 електрона във валентната си обвивка.
Вижте също Органични и неорганични съединения.
Междумолекулни връзки
Молекулите се свързват чрез сили, които правят възможно образуването на вещества в течно или твърдо състояние.
Дипол-диполни връзки или сили
Слабите междумолекулни връзки могат да се установят между полярните молекули, когато отрицателните полюси се привличат към положителните полюси и обратно. Например метанал Н2C = O е полярна молекула, с частичен отрицателен заряд върху кислорода и частичен положителен заряд върху водородите. Положителната страна на една метанална молекула привлича отрицателната страна на друга метанална молекула.
Водородни връзки или връзки
Водородната връзка или водородната връзка е връзка, която се установява между молекулите. Това се случва, когато водородът в молекулата е ковалентно свързан с кислород, азот или флуор. Кислородът, азотът и флуорът са атоми с по-висока електроотрицателност, следователно те привличат електроните по-силно, когато ги споделят с друг по-малко електроотрицателен атом.
Между молекулите на водата H има водородни връзки2O и NH амоняк3 както показва снимката:
Може да ви е интересно да видите:
- Атоми и молекули.
- Примери за органични и неорганични съединения.
- Метали и неметали
Препратки
Zumdahl, S.S., Zumdahl, S.A. (2014) Химия. Девето издание. Брукс / Коул. Белмонт.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5-то издание. Пиърсън Австралия. Мелбърн.