ატომის სტრუქტურა და მახასიათებლები

სურათი: SlidePlayer
ატომები ჩვენი სამყაროს ნაწილია. ყველა მატერია დამზადებულია ატომებისაგან, ამიტომ მნიშვნელოვანია უკეთ გავიგოთ, რისგან შედგება და რა ფუნქციები აქვთ. მასწავლებლის ამ გაკვეთილზე ჩვენ ვაპირებთ გითხრათ რა ატომის სტრუქტურა და მახასიათებლები. თუ გსურთ მეტი იცოდეთ ნაწილაკების შესახებ, რომლებიც ყველა საკითხს ქმნის, განაგრძეთ სტატიის კითხვა.
ინდექსი
- რა არის ატომები?
- ატომის სტრუქტურა
- ატომის ძირითადი მახასიათებლები
- რა არის იზოტოპები?
- როგორ გვხვდება ატომები ბუნებაში?
რა არის ატომები?
ატომი ეს არის ყველაზე პატარა ერთეული, რომელშიც შეიძლება დაიყოს მატერია მისი ქიმიური თვისებების, ანუ ქიმიური ელემენტის, თვისებების დაკარგვის გარეშე. ატომი წარმოშობს ყველაფერს, რაც ჩანს ან შეეხება, ვარსკვლავებიდან დაწყებული საუზმე ამ დილით.
თუ მისი ქიმიური თვისებების დაკარგვას განზე დავყრით, შეგვიძლია ვთქვათ, რომ ატომი შედგება სხვადასხვა ნაწილაკებისგან, რომლებსაც ეწოდება სუბატომიური ნაწილაკები. არსებობს სამი ტიპის სუბატომიური ნაწილაკები - პროტონები, ნეიტრონები და ელექტრონები - სხვადასხვა მახასიათებლებით.
ეს ნაწილაკები დაჯგუფებულია სხვადასხვა რიცხვში და ქმნის ქიმიურ ელემენტებს (ჟანგბადი, ნახშირბადი და ა.შ.), მაგრამ ისინი ყოველთვის განაწილდება ფიქსირებული სტრუქტურის შესაბამისად.

სურათი: Google Sites
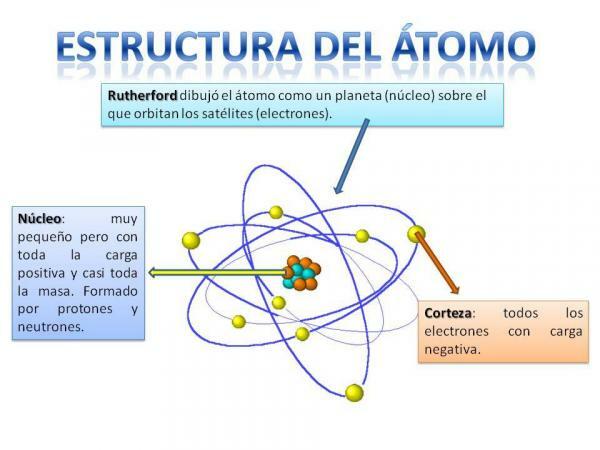
ატომის სტრუქტურა.
ატომის სტრუქტურა ფიქსირდება, ანუ, ჩვენ შეგვიძლია გვქონდეს სხვადასხვა ტიპის ატომები (წყალბადის ატომი, ჟანგბადის ატომი და ა.შ.), მაგრამ მათი სუბატომური ნაწილაკები ყოველთვის ორგანიზებულია პლანეტარული სისტემის ანალოგიურად.
თქვენ ნამდვილად გახსოვთ, თუ როგორ არის ორგანიზებული მზის სისტემა: მზე არის ცენტრში და მის გარშემო აქედან პლანეტები ბრუნავენ და აღწერს სხვადასხვა ორბიტებს, ზოგი უფრო ახლოსაა და სხვები მზე. ატომების შემთხვევაში, ცენტრში მდებარეობს ძირითადი, ფორმის მაყვლის მსგავსია და შედგება ნეიტრონები და პროტონები.
ბირთვის გარშემო არის ქერქი რომელია ის ტერიტორია, რომლის მეშვეობითაც ელექტრონები. ადრე ფიქრობდნენ, რომ ელექტრონები აღწერდნენ გარკვეულ ორბიტებს, მსგავსი პლანეტების მსგავსად, ახლა კი ასეა იცის, რომ ეს ორბიტები არც თუ ისე კარგად არის განსაზღვრული და უფრო ჰგავს იმ სფეროებს, სადაც უფრო ხშირად აღმოვჩნდებით ელექტრონები.
სურათი: REA - გეგმა Ceibal
ატომის ძირითადი მახასიათებლები.
ატომის სტრუქტურასა და მახასიათებლებზე ამ გაკვეთილის გასაგრძელებლად მნიშვნელოვანია ყურადღება გავამახვილოთ იმ ელემენტებზე, რომლებიც ატომს მიიჩნევენ ასეთად.
ამისათვის ჩვენ უნდა ვუპასუხოთ ამ კითხვას: რატომ გადაწყვეტს ყველა ატომი საკუთარი თავის გარკვეულ წესრიგს? პასუხი მარტივია: ეს განპირობებულია ელექტრული მიმზიდველი ძალები. ატომის ბირთვი შედგება ნეიტრონებისგან, რომლებსაც არ აქვთ ელექტრული მუხტი და პროტონები, რომლებსაც აქვთ დადებითი ელექტრული მუხტი. ხოლო ელექტრონებს აქვთ უარყოფითი ელექტრული მუხტი, ამიტომ ბირთვსა და ელექტრონებს შორის მსგავსი მიმზიდველი ძალაა წარმოიქმნება მაგნიტის ორ პოლუსს შორის, მაგრამ არ არის ისეთი ძლიერი, რომ ელექტრონები "დაეცეს" ძირითადი
ეს უკეთ გასაგებია, თუ გავითვალისწინებთ ძირითადი ზომა: თუ ატომს ჰქონდა, მაგალითად, საფეხბურთო სტადიონის განზომილება, ბირთვს ექნებოდა ბურთის განზომილება ცენტრში მინდორიდან რამდენად მიმზიდველი ძალა უნდა გამოეწვია საფეხბურთო ბურთს სტადიონის გამათეთრებლებისთვის.
ნეიტრონების ფუნქცია
ახლა ალბათ გაინტერესებთ და რა როლს ასრულებენ ნეიტრონები? ელექტრული მუხტის არქონის მიუხედავად, ნეიტრონებს დიდი როლი აქვთ ატომში: ისინი მასის 99% -ს შეადგენენ. თუ ის დაგეხმარებათ გახსოვდეთ, შეგვიძლია ვთქვათ, რომ ატომი ჰგავს ბანდიტს, რომელიც სამ მეგობარს მოიცავს: მძიმე ნეიტრონი, პოზიტიური პროტონი და უარყოფითი ელექტრონი, რომელიც მიდის ნეიტრონის გარშემო და ელექტრონი.
ელექტრონების მოძრაობა
ამ ეტაპზე მინდა დავუბრუნდეთ იმას, რაც ჩვენ მელნის ჭურჭელში დავტოვეთ: ორბიტები, რომლებსაც ელექტრონები აღწერენ ბირთვის გარშემო. ჩვენ ეს ვთქვით ელექტრონები ბირთვის გარშემო ბრუნავენ რატომ აკეთებენ პლანეტები მზის გარშემო, ზოგი უფრო ახლოსაა, ვიდრე სხვები? ელექტრონები ბრუნავენ ამა თუ იმ გარსში იმ ენერგიის მიხედვით, რაც მათ ბირთვიდან მოშორებით უნდა დატოვონ, ანუ იმ ელექტრონებს, რომლებიც უფრო ახლოს არიან ბირთვთან, არ აქვთ საკმარისი ძალა ბირთვიდან მოშორებისას, ხოლო ქერქის ყველაზე შორეულ შრეებში (ორბიტალებში) მათ აქვთ მეტი ენერგია და შეძლეს უფრო შორს დაშორება ძირითადი გარდა ამისა, თითოეულ ორბიტალში მაქსიმალური ტევადობაა 8 ელექტრონი (ოქტეტების წესი).
ატომის ნაწილაკები
ჩვენ ვაპირებთ დავუბრუნდეთ სხვა მიდგომას, რომელიც ადრე გავაკეთეთ, მაგრამ არ ავუხსენი: ატომები შედგება ნეიტრონები, პროტონები და ელექტრონები, რომლებიც ყოველთვის აერთიანებენ ბირთვისა და ქერქის ერთნაირ სტრუქტურას, მაგრამ ისინი ამას აკეთებენ სხვადასხვა რაოდენობით და ქმნიან სხვადასხვა ქიმიურ ელემენტებს. როგორ შეგვიძლია მივიღოთ ეს მრავალი ელემენტი, რომლებიც აერთიანებს მხოლოდ 3 ტიპის ნაწილაკებს? ქიმიური ელემენტები, რომლებიც პერიოდულად გინახავთ წარმოდგენილი პერიოდულ სისტემაში, ახასიათებს გარკვეული ატომური რიცხვის არსებობა.
ატომური ნომერი (Z) იგი მიუთითებს ამ ტიპის ატომების ბირთვში პროტონების რაოდენობაზე, რაც უდრის ელექტრონების რაოდენობას ნორმალურ პირობებში. ასე მაგალითად, ყველა ატომი, რომელსაც აქვს 6 პროტონი (Z = 6), იქნება ნახშირბადის ატომი და მათ ექნებათ იგივე ქიმიური თვისებები; 5 პროტონის მქონე ატომები (Z = 5) იქნება ბორის ატომები, იგივე ქიმიური თვისებებით, რაც ერთმანეთთან და განსხვავდება ნახშირბადის ატომებისგან. თქვენ არ უნდა აურიოთ ატომური რიცხვი ატომურ წონაში ან მასის ნომერი (A), რაც ნეიტრონებისა და პროტონების წონის ჯამია (ელექტრონების წონა უმნიშვნელოა მთლიანი ბირთვის წონის მიმართ).

სურათი: SlidePlayer
რა არის იზოტოპები?
ბუნებაში გვხვდება ელემენტების სხვადასხვა "ქვეტიპები" იზოტოპები. დარწმუნებული ვარ, რომ რაღაც მომენტში გსმენიათ ნახშირბადოვანი 14-ის შესახებ, ნახშირბადის რადიოაქტიური იზოტოპი, რომელიც გამოიყენება, სხვათა შორის, ნაშთების ასაკის დასადგენად. იზოტოპები არის ორი ატომი იგივე რაოდენობის პროტონებით (იგივე ატომური ნომერი), მაგრამ განსხვავებული რაოდენობის ნეიტრონები, (განსხვავებული ატომური მასა). ჩვეულებრივ, იმავე ელემენტის იზოტოპებს ასახელებენ ელემენტის სახელწოდებით, რასაც მოსდევს მისი ატომური მასა.
ჩვენს მაგალითში, ორივე იზოტოპი ნახშირბადია, ამიტომ მათ აქვთ ატომური რიცხვი 6 (Z = 6) მაგრამ ნახშირბადს 12 ("ნორმალური" ნახშირბადი) აქვს ატომური წონა 12 და ნახშირბადის 14 ატომური წონა 14. იგივე ელემენტის იზოტოპებს ძალიან ჰგავს ქიმიური და ფიზიკური თვისებები. ნახშირბადის 14 შემთხვევაში, ნახშირბადის 12-ისგან განსხვავებით, ეს არის რადიოაქტიური იზოტოპი, რომელიც იმყოფება ნახშირბადის შემცველ ყველა ელემენტში, მათ შორის ცოცხალ არსებებში.
ამით ჩვენ ვამთავრებთ ამ გაკვეთილს ატომის სტრუქტურასა და მახასიათებლებზე. ვიმედოვნებთ, რომ ეს თქვენთვის სასარგებლო აღმოჩნდა.

სურათი: თქვენი ამოცანები
როგორ გვხვდება ატომები ბუნებაში?
ატომები გვხვდება იზოლირებულად, მაგრამ ყველაზე ნორმალურია მათი პოვნა ჯგუფებში გაერთიანებულია დაურეკა მოლეკულები.
მოლეკულები შეიძლება შედგებოდეს იგივე ელემენტის ატომებისაგან (მაგალითად, ჟანგბადის მოლეკულა, რომელიც შედგება ორი ატომისგან ჟანგბადი) ან სხვადასხვა ელემენტის ატომების მქონე ჯგუფების მიერ (წყალბადის ორი ატომი და ერთი ჟანგბადი ქმნის მოლეკულას წყალი). ელემენტების ამ ჯგუფებს ეწოდება მოლეკულები, რომლებიც, თავის მხრივ, შეიძლება ერთმანეთთან შერწყმდეს და სხვადასხვა უფრო და უფრო რთული დაჯგუფების ფორმირება მათი რეაქტიულობისა და მათი ქიმიური დამოკიდებულების შესაბამისად წყარო ქიმიური ბმულები.
თუ გსურთ წაიკითხოთ სხვა მსგავსი სტატიები ატომის სტრუქტურა და მახასიათებლებიგირჩევთ შეიყვანოთ ჩვენი კატეგორია ატომი.



