5 SKIRTUMAI tarp FISIJOS ir branduolinės sintezės

Klasikinė chemija teigia atomas tai mažiausias ir nedalomas materijos vienetas. Cheminės reakcijos yra tos, kuriose atomai, sudarantys molekules, rekombinuojasi, kad iš pradžių esančių žmonių sąveikos dėka atsirastų naujų molekulių. Tačiau atomai gali užmegzti sąveiką su dalelėmis, sudarančiomis jų branduolius. Tai vadinamosios branduolinės reakcijos.
Šioje Dėstytojo pamokoje sužinosime, kokie yra branduolinių reakcijų tipai ir kas yra skilimo ir branduolio sintezės skirtumus.
Ir skilimas, ir branduolio sintezė yra branduolinės reakcijos. Tai yra procesai, kurių metu atominiai branduoliai arba atomų branduoliai ir subatominės dalelės sąveikauja tarpusavyje. Paprasčiausia branduolinė reakcija, kuri atrandama pirmiausia, yra radioaktyvumas, kurį sudaro savaiminis nestabilaus atomo branduolio skaidymas į paprastesnį, turintį didesnį stabilumą ir mažesnę energiją. Ši skilimo reakcija išskiria energiją radiacijos pavidalu.
Likę branduolinių reakcijų tipai paprastai yra du branduoliai arba dalelės, kurios reaguoja, kad gautų reakcijos produktus. Kad įvyktų branduolinė reakcija, a
aktyvavimo energija. Branduolinės reakcijos išskiria energiją iš kinetinės energijos (energijos, susijusios su judesiu) atomai reakcijos produktas, o kartais ir į gama spindulių (didelės energijos elektromagnetinės spinduliuotės) spinduliavimą.Branduolio sintezės apibrėžimas
Kaip rodo pavadinimas, branduolių sintezė yra reakcijos tipas dvi šviesos šerdys susijungia, kad susidarytų sunkesnė šerdis, bet kurio masė yra šiek tiek mažesnė nei dviejų branduolių, iš kurių ji buvo suformuota, masių suma. Šis skirtumas tarp galutinės ir pradinės masės yra atiduodamas energijos pavidalu pagal reakciją: E = m · c2.
Branduolio dalijimosi apibrėžimas
Branduolio dalijimasis yra priešinga reakcija į sintezę. Tai reakcija, kurioje sunki šerdis, bombarduojamas dalelių suskaidomas, kad atsirastų lengvesni šerdys, taip pat generuojantys kitus reakcijos produktus, tokius kaip subatominės dalelės ir gama spinduliai.

Vaizdas: „Mate fitness“
Dabar, kai žinote prasmę, pasinerkime tiesiai, norėdami atrasti skilimo ir branduolio sintezės skirtumus. Yra penki pagrindiniai ir čia mes juos apibendriname.
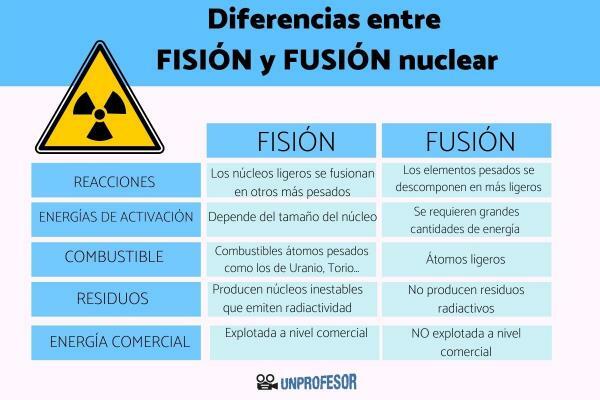
1.- Tai priešingos reakcijos
Kaip komentavome ankstesniame skyriuje, sintezė ir skilimas jos yra dvi priešingos branduolinės reakcijos. Kadangi susiliejime lengvieji branduoliai susilieja į sunkesnius, o dalijimosi metu sunkiųjų elementų branduoliai skyla į lengvesnius.
2.- Aktyvinimo energijos
- Skilimas: Skilimo reakcijų atveju aktyvacijos energija priklauso nuo branduolio dydžio, sunkiųjų branduolių atveju reakcija vyksta savaime. Lengvesnių branduolių atveju reakciją reikia sukelti bombarduojant branduolius mažos energijos dalelėmis. Todėl branduolio dalijimosi atveju energijos kiekis, reikalingas reakcijai pradėti, yra labai mažas arba jo visai nėra.
- Sintezė: Branduolio sintezės atveju reakcijai suaktyvinti reikalingi dideli energijos kiekiai. Norint pradėti branduolių sintezės reakciją, kuro temperatūrą reikia pakelti iki 100 milijonų ºC, kad kuro atomai pereina į plazmos būseną (būseną, kurioje elektronai laisvai juda nepriklausomai nuo branduolių atominis). Šio tipo būklė būna žvaigždžių viduje, kur vyksta branduolio sintezės reakcijos.
3.- Kuro gausa
- Skilimas: Šioms branduolinėms reakcijoms kaip degalai reikalingi sunkūs atomai, tokie kaip uranas, toris arba plutonis. Sunkūs elementai yra mažiausiai visatoje ir jie yra mažomis proporcijomis žemės plutoje. Be to, šių sunkiųjų elementų radioaktyvieji izotopai gamtoje yra sumaišyti su kitais neradioaktyviais izotopais arba kaip mineralų dalis.
- Sintezė: Šviesos atomai, dalyvaujantys branduolio sintezės reakcijose, yra gausiausiai visatoje, kur daugiausia yra vandenilio (lengviausias elementas), kuris sudaro 92% viso kiekio. Nors vandenilio Žemėje yra gana nedaug, jo galima gauti iš atsinaujinančių šaltinių, tokių kaip celiuliozės biomasė, arba iš vandens. Dėl šios priežasties vandenilis laikomas a neišsenkantis kuras.
4. Likučiai, atsirandantys dėl reakcijos
- Skilimas: Branduolio dalijimosi reakcijos sukelia nestabilius branduolius, kurie labai ilgą laiką skleidžia radioaktyvumą, nes jie turi pusinės eliminacijos laikas (laikotarpis, būtinas perpus sumažinti radioaktyviųjų išmetimų kiekį), kuris gali būti ilgesnis nei 30 metų. radioaktyviųjų atliekų gamyba Branduolio dalijimosi reakcijose jie kelia pavojų žmonių sveikatai ir aplinkai, todėl turi būti tinkamai valdomi ir saugomi.
- Sintezė: Branduolio sintezės reakcijos nesudaro radioaktyviųjų atliekų, todėl ji laikoma švaria energija, nes tai yra reakcijos jie nesudaro teršiančių likučių. Protonų-protonų susiliejimo reakcijos atveju, viena iš labiausiai paplitusių sintezės reakcijų, gautas produktas yra tauriosios dujos - helis. Helis yra labai mažai reaguojantis elementas, nekeliantis pavojaus žmonių sveikatai ir aplinkai.
5.- Energijos gavimas komerciniu lygiu
- Skilimas: Šiuo metu tai yra vienintelis branduolinės reakcijos tipas turi reikiamą techniką, kad būtų galima komerciškai panaudoti. Visose atominėse elektrinėse naudojamos branduolio dalijimosi reakcijos.
- „Fusion“: šiandien, mes dar neturime reikiamos technologijos gauti elektros energijos branduolių sintezės būdu. Pagrindinis techninis sunkumas yra aukšta temperatūra, reikalinga reakcijai pradėti, nes Mes neturime jokios medžiagos, kuri galėtų atlaikyti šias temperatūras ir kur įmanoma apriboti reakciją.