تطور الجدول الدوري: من إنشائه إلى اليوم
الجدول الدوري هو واحد من الرموز الأكثر شهرة من العلم. على الرغم من أن عام 2019 كان الذكرى السنوية الـ 150 لإنشائه ، إلا أنه ليس وثيقة نهائية بأي حال من الأحوال. في هذا الدرس من المعلم سوف نرى ما تطور الجدول الدوري منذ إنشائها إلى يومنا هذا وما جعله ذلك ممكنًا بفضل التقدم في معرفة الذرات وخصائصها.
فهرس
- ما هو الجدول الدوري؟
- الجدول الدوري الأول: الأصل
- تاريخ الجدول الدوري وتطوره
ما هو الجدول الدوري؟
ال الجدول الدوري النظام الدوري للعناصر هو الوثيقة العلمية التي تركز على المزيد من المعلومات في مساحة أقل وتشكل واحدة من أقوى أيقونات العلم. يحتوي على جزء جيد من المعرفة التي لدينا عن الكيمياء. لا توجد وثيقة مماثلة في أي تخصص علمي آخر.
الجدول الدوري للعناصر هو أ نظام تصنيف العناصر الكيميائية لقد بدأ منذ أكثر من 200 عام. لقد كان نظام التصنيف هذا ينمو ويتغير بمرور الوقت ، مع تقدم العلم واكتشاف أنظمة جديدة. العناصر الكيميائية. ومع ذلك ، فقد تم إدخال التعديلات المختلفة مع الحفاظ على هيكلها الأساسي سليمًا.
سمي الجدول الدوري بهذا الاسم لأن يعبر بيانيا طريقة تكرارها على فترات منتظمة معينة
الخواص الكيميائية. إنه نوع من التمثيل ثنائي الأبعاد أو ثلاثي الأبعاد في تمثيلاته الأكثر حداثة.في ال الجدول الدوري الكلاسيكي (ثنائي الأبعاد) يتم ترتيب العناصر الكيميائية في مجموعات أو عائلات ويتم تمثيلها في الجدول الدوري الحالي في أعمدة رأسية. يؤدي الترتيب المرتب لهذه المجموعات في الأعمدة إلى ظهور سلسلة من الصفوف تسمى فترات ، حيث يتم ترتيب العناصر وفقًا لوزنها الذري. يتكون الجدول الدوري من سبع فترات تختلف في الطول.

الجدول الدوري الأول: الأصل.
قبل مندليف ، طور علماء آخرون أنظمة تصنيف للعناصر الكيميائية. ولكن ، على عكس الجدول الدوري للعناصر ، فقد كانت كذلك مجرد قوائم بالعناصر المعروفة ؛ بينما يتميز الجدول الدوري بخصوصية أنه نظام تصنيف في بعدين (صفوف وأعمدة) أو ثلاثة أبعاد ، بأحدث إصداراتها ، حيث يتم ترتيب العناصر الكيميائية على التوالي طبقات.
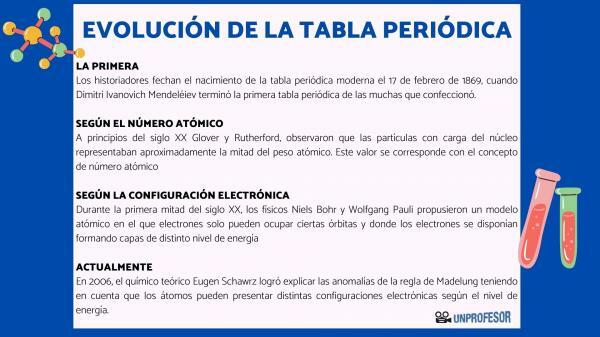
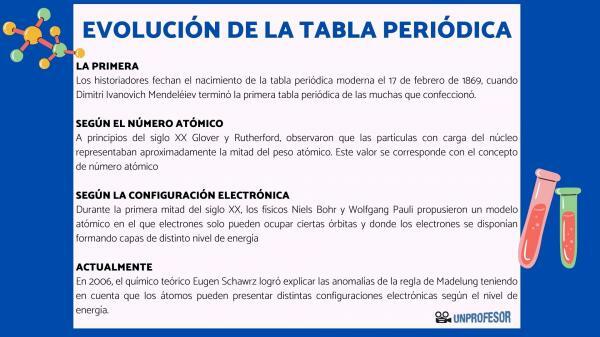
لهذا السبب ، يؤرخ المؤرخون ولادة الجدول الدوري الحديث ١٧ فبراير ١٨٦٩ ، متي ديميتري إيفانوفيتش مندليف انهي ال الجدول الدوري الأول من الكثير الذي صنعه. يتكون هذا الجدول من 63 عنصرًا مرتبة في العائلات وترك مساحات فارغة للعناصر التي لم يتم بعد اكتشفت ، ولكن استنتج منها وزنها الذري (كما في حالة الغاليوم والجرمانيوم و سكانديوم)
كانت البيانات الأساسية لاكتشاف الجدول الدوري هي المعرفة السابقة بـ الوزن الذري من كل عنصر.
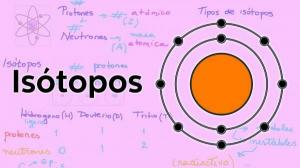
ما هو الوزن الذري والعدد الذري؟
هذا العدد يمثل وزن الذرة وكانت القيمة الوحيدة القابلة للقياس لـ ذرات. لكنها لم تكن بأي حال من الأحوال من القياسات المباشرة (لا توجد أجهزة قياس تسمح بوزن الذرات المعزولة) ولكنها كانت نظامًا أنشأ معيار تم فيه إعطاء قيمة تعسفية لـ 1 لذرة الهيدروجين وتم حساب قيمة الوزن الذري للعناصر المتبقية فيما يتعلق بهذا نمط.
أول حسابات العدد الذري نفذ الكيميائي الإنجليزي من العناصر جون دالتون، وأثارت جدلاً علميًا كبيرًا خلال النصف الأول من القرن التاسع عشر. ومع ذلك ، في النصف الثاني من القرن التاسع عشر ، كان هناك بالفعل إجماع رائع على نظام حساب الأوزان الذرية للعناصر. أصبح الوزن الذري من مندليف وما بعده معيارًا رئيسيًا للترتيب الصحيح للعناصر داخل الجدول الدوري.
عندما أمر منديليف العناصر المعروفة وفقًا لـ زيادة الوزن الذري، لاحظ ظهور الخصائص المتكررة التي سمحت للعناصر بالتجميع في مجموعات أو عائلات من العناصر التي كانت متشابهة مع بعضها البعض. ومع ذلك ، في بعض الحالات ، لم يستجب ترتيب العناصر وفقًا لوزنها الذري لأوجه التشابه بين العناصر التي لوحظت وتغير منديليف موضع 17 عنصرًا في ترتيب الجدول الدوري على الرغم من أوزانهم الذرية ، حتى يمكن تجميعهم مع تلك العناصر التي قدموا بها مقارنات.
أظهرت هذه التغييرات أن بعض الأوزان الذرية المقبولة لم تكن صحيحة وتم إعادة حسابها. على الرغم من التصحيحات في الأوزان الذرية ، لا تزال هناك عناصر يجب وضعها في مواضع أخرى غير تلك التي تشير إليها أوزانها الذرية.

الصورة: BBC.com
تاريخ الجدول الدوري والتطور.
على الرغم من مساهمة Mendeleev التي لا شك فيها ، فإن الجدول الدوري للعناصر ليس نتيجة عمل باحث واحد. بالإضافة إلى مندليف ، خلال النصف الثاني من القرن التاسع عشر وطوال القرن العشرين واصل الكيميائيون البحث عن أفضل طريقة لتنظيم المعلومات حول العناصر الكيميائية معروف. أكثر من ذلك بالنظر إلى أنه خلال هذا الوقت اكتشاف عناصر كيميائية جديدة أو مواد بسيطةبفضل مقياس الطيف (الذي يدرس التفاعلات بين الذرات والإشعاع الكهرومغناطيسي).
ال تصنيف العناصر في الجدول الدوري كان يعتمد في البداية على الحسابات الأولية لـ الأوزان الذرية من العناصر وكشف التشابهات التي سمحت للعناصر بأن يتم تجميعها في عائلات متشابهة. ومع ذلك ، لا يمكن تفسير سبب ظهور هذه الخصائص الدورية. كان ذلك طوال القرن العشرين ، مع اكتشاف البنية الإلكترونية ، عندما تم فهم سبب هذه الدورية في خصائص العناصر.
العدد الذري كترتيب فرز
في بداية القرن العشرين جلوفر وراذرفورد، لاحظ أن الجسيمات المشحونة في النواة تمثل حوالي نصف الوزن الذري. هذه القيمة تتوافق مع مفهوم العدد الذري والذي يعرف بأنه عدد البروتونات في النواة الذرية والذي يتطابق مع عدد الإلكترونات في الذرة المحايدة. هذه القيمة الجديدة تبرر التغييرات في موضع بعض العناصر التي تم تنفيذها حتى ذلك الحين. على سبيل المثال تغيير الموقف بين التيلوريوم واليود.
في عام 1913 ، هنري موسلي أكد ترتيب الجدول كدالة للعدد الذري بواسطة مطياف الأشعة السينية. الترتيب وفقًا للعدد الذري لا يزال ساريًا حتى اليوم.
في الوقت نفسه ، خلال القرن العشرين ، استمر اكتشاف عناصر كيميائية جديدة بفضل ميكانيكا الكم وتطور تقنية قصف الذرات بالجسيمات ، من النصف الثاني من القرن. مع هذه التقنية الجديدة كان من الممكن خلق عناصر اصطناعية التي ليست موجودة في الطبيعة.
على الرغم من إحراز تقدم في الترتيب الصحيح للعناصر داخل الجدول الدوري ، إلا أنه لا يزال سبب تكرار حدوث بعض الخصائص (الخصائص دوري). تطوير ميكانيكا الكم (فرع الفيزياء الذي يدرس سلوك الضوء والذرات على نطاق مجهري) من عام 1920 كان حاسما لشرح سبب هذه الخصائص.
التكوين الإلكتروني كتفسير للخصائص الدورية
خلال النصف الأول من القرن العشرين علماء الفيزياء نيلز بور ص وولفجانج باولي اقترحوا نموذجًا ذريًا حيث يمكن للإلكترونات أن تحتل فقط مدارات معينة وحيث يتم ترتيب الإلكترونات لتشكيل طبقات من مستويات طاقة مختلفة. تُعرف الطريقة التي يتم بها توزيع الإلكترونات في المدارات في الأصداف المختلفة أو مستويات الطاقة التكوين الإلكترونية.
كان اكتشاف ترتيب الإلكترونات في تكوينات الإلكترون أمرًا أساسيًا لفهم دورية الخصائص. دوري ، حيث لوحظ أن هذه الخصائص مرتبطة ارتباطًا وثيقًا بالتكوين الإلكتروني الخارجي للذرات (طبقة فالنسيا).
تم إنشاء الترتيب الذي تملأ به الإلكترونات المدارات الذرية في عام 1930 من قبل الفيزيائي إروين مادلونغ الذي وضع قاعدة عددية لترتيب الملء. تُعرف هذه القاعدة باسم حكم مادلونغ وهي قاعدة تجريبية لا يمكن تفسيرها بواسطة ميكانيكا الكم.
تسلسل التعبئة بسيط للصفوف الثلاثة الأولى من الجدول الدوري ، ولكن في الصف الرابع ، حيث توجد عناصر الانتقال ، يخضع ترتيب التعبئة لسلسلة من التعديلات. يوجد إجمالي 20 عنصرًا شاذًا لا تتبع هذه القاعدة.
يستمر تطور الجدول اليوم
في عام 2006 ، الكيميائي النظري يوجين شورز تمكن من شرح الانحرافات في قاعدة مادلونغ مع الأخذ في الاعتبار أن الذرات يمكن أن يكون لها تكوينات إلكترونية مختلفة اعتمادًا على مستوى الطاقة. بحساب المتوسطات ، تتوافق تكوينات الإلكترون لمعظم العناصر مع قاعدة مادلونغ.
لا يزال الجدول الدوري موضع نقاش في القرن الحادي والعشرين ، على الرغم من الترتيب أو التكوين الإلكتروني لـ العناصر ، لا يزال من الصالح شرح هذا الترتيب والأشكال الشاذة التي لوحظت في التكوينات الإلكترونية عن طريق نظرية.
إذا كنت ترغب في قراءة المزيد من المقالات المشابهة لـ تطور الجدول الدوري - ملخص، نوصيك بإدخال فئة الذرة.
فهرس
مؤلفون مختلفون. (2019)خاص: الجدول الدوري. البحث والعلوم. برشلونة: Scientific Press S.A.