الأنواع العشرة من الروابط الكيميائية (موضحة بأمثلة)
الروابط الكيميائية هي القوى التي تربط الذرات معًا لتشكيل الجزيئات. هناك ثلاثة أنواع من الروابط بين الذرات:
- السندات معدنية.
- الرابطة الأيونية.
- الرابطة التساهمية: غير قطبية ، قطبية ، بسيطة ، مزدوجة ، ثلاثية ، مجددة.
بفضل هذه الروابط ، تتشكل جميع المركبات الموجودة في الطبيعة. هناك أيضًا قوى تربط الجزيئات معًا ، والمعروفة باسم الروابط بين الجزيئات ، مثل:
- روابط أو جسور الهيدروجين.
- قوى ثنائي القطب.
بعد ذلك ، نشرح كل من هذه الروابط.
| أنواع الرابطة الكيميائية | صفة مميزة | أمثلة | |
|---|---|---|---|
| معدن | تطفو أيونات المعادن في بحر من الإلكترونات المتحركة. | العناصر المعدنية: الصوديوم والباريوم والفضة والحديد والنحاس. | |
| أيوني | نقل الإلكترونات من ذرة إلى أخرى. | كلوريد الصوديوم+Cl- | |
| تساهمية | الغير قطبي | مشاركة الإلكترونات بالتساوي بين ذرتين. | الهيدروجين الجزيئي HH أو H2 |
| قطبي | يشارك الإلكترونات بشكل غير متساو بين ذرتين. | جزيء الماء H2أو | |
| بسيط | شارك زوجًا من الإلكترونات. | جزيء الكلور Cl2 Cl-Cl | |
| مزدوج | شارك زوجين من الإلكترونات. | جزيء الأكسجين O2 س = س | |
| ثلاثية | شارك ثلاثة أزواج من الإلكترونات. | جزيء النيتروجين N≣N أو N2 | |
| Dative | تشترك ذرة واحدة فقط في الإلكترونات. | الرابطة بين النيتروجين والبورون في مركب الأمونيا-البورون ثلاثي فلوريد. | |
| القوى بين الجزيئات | جسر الهيدروجين | تنجذب الهيدروجين في جزيء واحد إلى الذرات الكهربية للجزيء الآخر. | الروابط الهيدروجينية بين الهيدروجين في جزيء ماء مع الأكسجين في جزيء ماء آخر. |
| ثنائي القطب ثنائي القطب | تجذب الجزيئات ذات القطبين الكهربائيين القطبين المعاكسين للجزيئات الأخرى. | التفاعلات بين جزيئات الميثان H2ج = س |
السندات معدنية
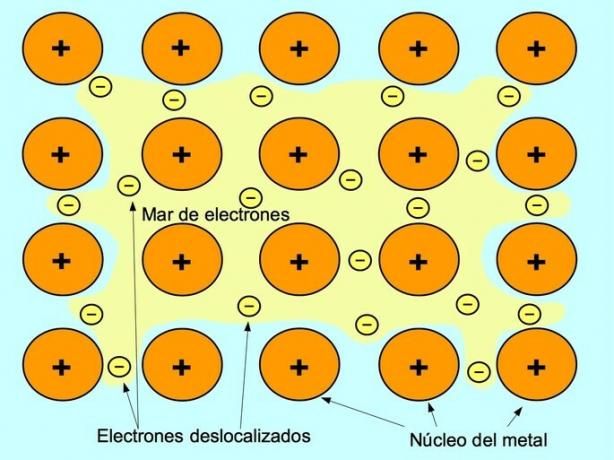
الرابطة المعدنية هي قوة الجذب بين الأيونات الموجبة للعناصر المعدنية والإلكترونات السالبة التي تتحرك بحرية بين الأيونات. يتم تجميع ذرات المعادن بإحكام ، وهذا يسمح للإلكترونات بالحركة داخل شبكة الذرات.
في المعادن ، يتم إطلاق إلكترونات التكافؤ من ذرتها الأصلية وتشكل "بحرًا" من الإلكترونات يطفو حول الهيكل المعدني بأكمله. يؤدي هذا إلى تحول ذرات المعدن إلى أيونات معدنية موجبة الشحنة تتجمع معًا.
يتم إنشاء الرابطة المعدنية بين العناصر المعدنية مثل الصوديوم Na ، الباريوم Ba ، الكالسيوم Ca ، المغنيسيوم Mg ، الذهب Au ، الفضة Ag والألمنيوم Al.
الرابطة الأيونية
الرابطة الأيونية هي القوة التي تربط عنصر فلزي ، مثل الصوديوم أو المغنيسيوم ، بعنصر غير معدني ، مثل الكلور أو الكبريت. يفقد المعدن الإلكترونات ويتحول إلى أيون فلزي موجب يسمى الكاتيون. تمر هذه الإلكترونات إلى العنصر غير المعدني وتتحول إلى أيون سالب الشحنة يسمى أنيون.
تتحد الكاتيونات والأنيونات وتشكل شبكة ثلاثية الأبعاد يتم الحفاظ عليها بواسطة قوى الجذب الكهروستاتيكي بين الأيونات ذات الشحنات المختلفة. هذه القوى تشكل مركبات أيونية.
تتكون القشرة الأرضية بشكل أساسي من مركبات أيونية. معظم الصخور والمعادن والأحجار الكريمة هي مركبات أيونية. على سبيل المثال:
- كلوريد الصوديوم كلوريد الصوديوم: العنصر المعدني هو الصوديوم الذي ينقل إلكترونًا إلى الكلور ، وهو العنصر غير المعدني.
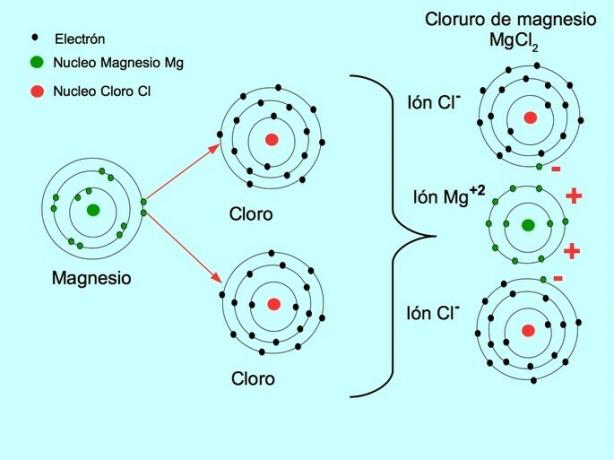
- كلوريد المغنيسيوم MgCl2: يتبرع Magnesium Mg بإلكترونين لذرتين من الكلور ، كما هو موضح في الشكل أدناه:
أنظر أيضا الفرق بين الكاتيونات والأنيونات.
الرابطة التساهمية
تتشكل الرابطة التساهمية عندما تشترك ذرتان غير معدنيتان في الإلكترونات. يمكن أن تكون هذه الرابطة من عدة أنواع اعتمادًا على تقارب إلكترونات الذرات وكمية الإلكترونات المشتركة.
الرابطة التساهمية اللاقطبية
الرابطة التساهمية غير القطبية هي الرابطة التي تتكون بين ذرتين حيث يتم تقاسم الإلكترونات بالتساوي. تحدث هذه الرابطة عادةً في جزيئات متماثلة ، أي جزيئات مكونة من ذرتين متساويتين ، مثل جزيء الهيدروجين H2 وجزيء الأكسجين O2.

الرابطة التساهمية القطبية
تتشكل الرابطة التساهمية القطبية عندما تشترك ذرتان في الإلكترونات ولكن إحداهما لديها جاذبية أكبر للإلكترونات. هذا يجعل الجزيء لديه "قطب" أكثر سلبية مع المزيد من الإلكترونات والقطب المقابل أكثر إيجابية.
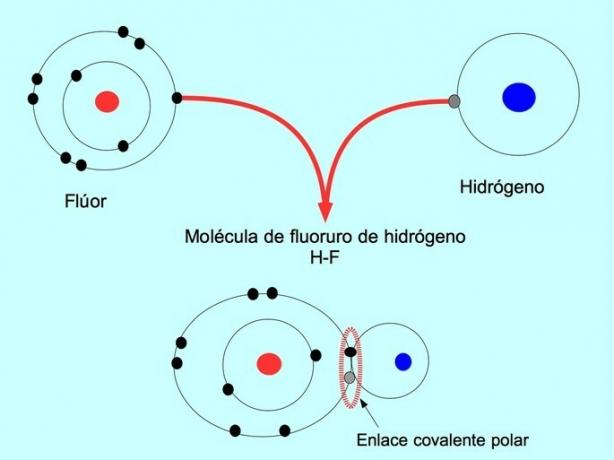
تُعرف الجزيئات التي لها هذا التوزيع أو عدم توازن الإلكترونات بالقطبية. على سبيل المثال ، في فلوريد الهيدروجين HF ، هناك رابطة تساهمية بين الهيدروجين والفلور ، لكن الفلور يحتوي على كهرسلبية أعلى ، لذلك فهو يجذب الإلكترونات بقوة أكبر مشترك.
رابطة تساهمية بسيطة
عندما تشترك ذرتان في إلكترونين ، واحدة من كل منهما ، تسمى الرابطة التساهمية المتكونة رابطة تساهمية واحدة.
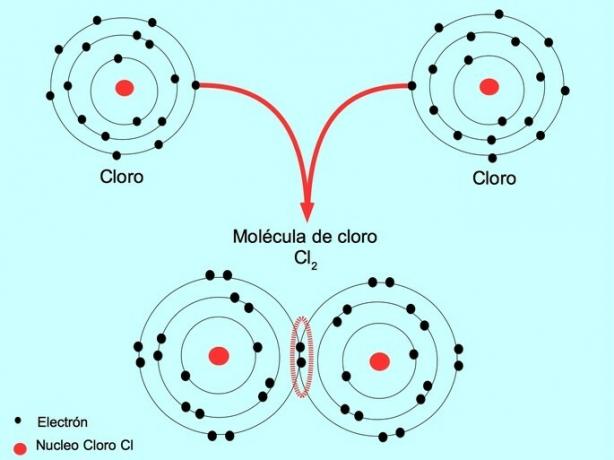
على سبيل المثال ، الكلور عبارة عن ذرة بها سبعة إلكترونات تكافؤ في غلافها الخارجي ، والتي يمكن ملؤها بثمانية إلكترونات. يمكن أن يتحد الكلور مع كلور آخر لتكوين جزيء الكلور Cl2 وهو أكثر استقرارًا من الكلور وحده.
الرابطة التساهمية المزدوجة
الرابطة التساهمية المزدوجة هي الرابطة التي يتم فيها مشاركة أربعة إلكترونات (زوجان) من الإلكترونات بين ذرتين. على سبيل المثال ، يحتوي الأكسجين على 6 إلكترونات في غلافه الأخير. عندما يتم الجمع بين اثنين من الأكسجين ، يتم مشاركة أربعة إلكترونات بين الاثنين ، مما يؤدي إلى احتواء كل منهما على 8 إلكترونات في الغلاف الأخير.
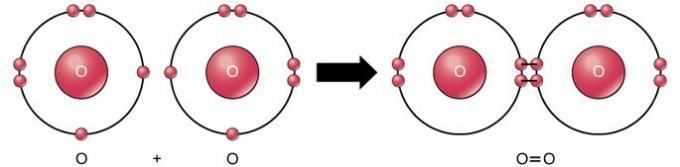
رابطة تساهمية ثلاثية
تتشكل الرابطة التساهمية الثلاثية عند مشاركة 6 إلكترونات (أو ثلاثة أزواج) بين ذرتين. على سبيل المثال ، في جزيء سيانيد الهيدروجين HCN ، يتم تكوين رابطة ثلاثية بين الكربون والنيتروجين ، كما هو موضح في الشكل أدناه:
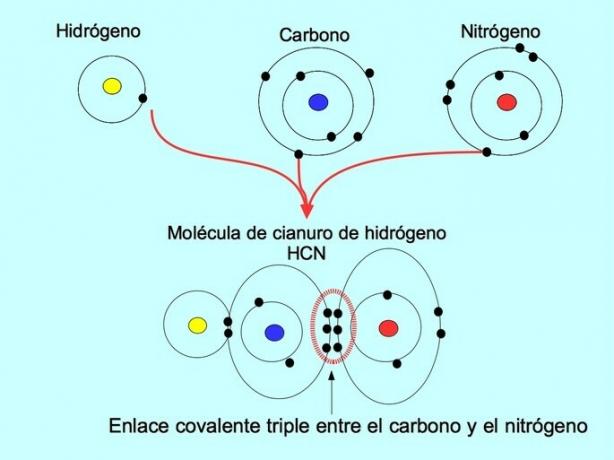
الرابطة التساهمية المنسقة أو dative
الرابطة التساهمية المنسقة أو dative هي الرابطة التي تتشكل عندما تساهم ذرة واحدة فقط في الرابطة بزوج إلكترون. على سبيل المثال ، عندما تتفاعل الأمونيا NH3 مع البورون ثلاثي فلوريد BF3، يرتبط النيتروجين مع إلكترونين بالبورون مباشرة ، والذي لا يوجد لديه إلكترونات متاحة للمشاركة. بهذه الطريقة ، يترك كل من النيتروجين والبورون 8 إلكترونات في غلاف التكافؤ.
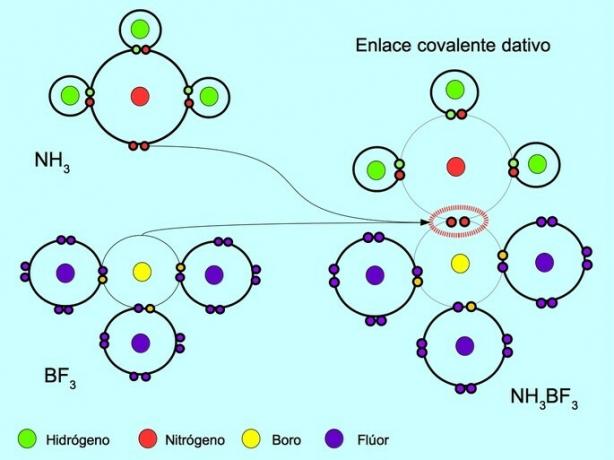
أنظر أيضا المركبات العضوية وغير العضوية.
الروابط بين الجزيئات
ترتبط الجزيئات بقوى تجعل من الممكن تكوين مواد في حالة سائلة أو صلبة.
روابط أو قوى ثنائية القطب
يمكن إنشاء روابط ضعيفة بين الجزيئات بين الجزيئات القطبية عندما تنجذب الأقطاب السالبة إلى الأقطاب الموجبة والعكس صحيح. على سبيل المثال ، methanal H.2C = O هو جزيء قطبي ، له شحنة سالبة جزئية على الأكسجين وشحنة موجبة جزئية على الهيدروجين. يجذب الجانب الإيجابي لأحد جزيئات الميثان الجانب السلبي لجزيء ميثان آخر.
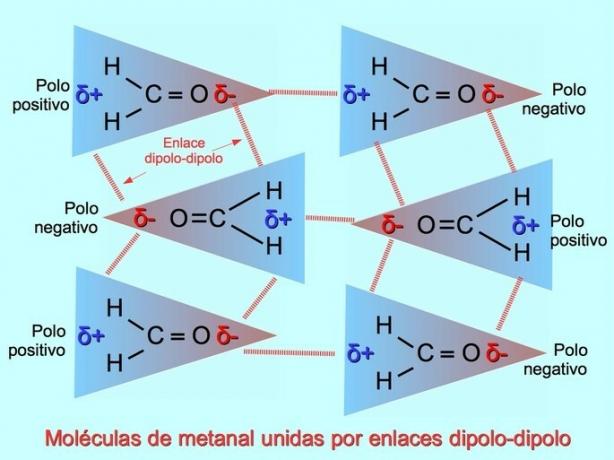
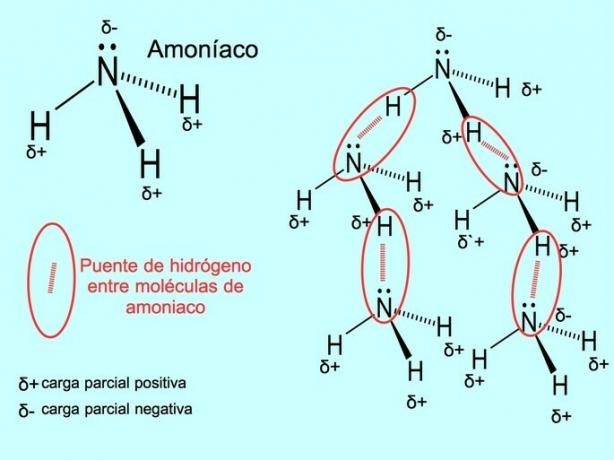
روابط أو روابط هيدروجينية
الرابطة الهيدروجينية أو الرابطة الهيدروجينية هي رابطة تنشأ بين الجزيئات. يحدث عندما يرتبط الهيدروجين في الجزيء تساهميًا بالأكسجين أو النيتروجين أو الفلور. الأكسجين والنيتروجين والفلور ذرات ذات كفاءة كهرومغناطيسية أعلى ، وبالتالي فهي تجذب الإلكترونات بقوة أكبر عندما تشاركها مع ذرة أخرى أقل كهرسلبية.
هناك روابط هيدروجينية بين جزيئات الماء H2O والأمونيا NH3 كما تظهر الصورة:
قد تكون مهتمًا برؤية:
- الذرات والجزيئات.
- أمثلة على المركبات العضوية وغير العضوية.
- المعادن واللافلزات
مراجع
Zumdahl، SS، Zumdahl، S.A. (2014) الكيمياء. الطبعة التاسعة. بروكس / كول. بلمونت.
كومنز ، سي ، كومنز ، ب. (2016) كيمياء هاينمان 1. الطبعة الخامسة. بيرسون استراليا. ملبورن.



