الفرق بين التفاعلات الماصة للحرارة والتفاعلات الطاردة للحرارة
أ تفاعل إمتصاص الحرارة يتطلب قوة بينما أ تفاعل طارد للحرارة تطلق الطاقة. يأخذ هذا التصنيف للتفاعلات الكيميائية في الاعتبار مشاركة الطاقة إما كمفاعل أو كمنتج.
الطاقة هي القدرة على القيام بالعمل أو إنتاج الحرارة. تذكر أن التفاعلات الكيميائية تنطوي على إعادة تنظيم الذرات بين المواد مع تكسر أو تكوين روابط كيميائية. بشكل عام ، يكون هذا التكوين أو الانهيار للروابط الكيميائية مصحوبًا بتغيرات في طاقة النظام.
| تفاعل إمتصاص الحرارة | تفاعل طارد للحرارة | |
|---|---|---|
| تعريف | تفاعل كيميائي حيث يتم امتصاص الطاقة. | تفاعل كيميائي حيث يتم إطلاق الطاقة في شكل حرارة. |
| أصل الطاقة | من البيئة | النظام |
| الطاقة الكامنة | المواد المتفاعلة أقل من المنتجات. | في المواد المتفاعلة أعلى منه في المنتجات. |
| إنتاج | ليس عفويًا | من تلقاء نفسها |
| تغيير الطاقة الداخلية | ΔE> 0 ؛ تغير الطاقة الداخلية أكبر من الصفر. | ΔE <0 ؛ تغير الطاقة الداخلية أقل من الصفر. |
| درجة حرارة | النقصان | يزيد |
| أمثلة | ردود الفعل في التركيب الضوئي والتوليف بشكل عام. | عود ثقاب مشتعل ، تفاعلات احتراق. |
ما هو رد الفعل الماص للحرارة؟
يكون التفاعل الكيميائي ماصًا للحرارة عندما تمتص الطاقة من البيئة. في هذه الحالة ، يتم نقل الحرارة من الخارج إلى داخل النظام. عندما نضع مقياس حرارة أثناء حدوث تفاعل ماص للحرارة ، تنخفض درجة الحرارة.
كلمة "ماص للحرارة" مشتقة من اليونانية ينتهي في وهو ما يعني "الداخل" و ثيرم وهو ما يعني "الحرارة". لا تستمر التفاعلات الماصّة للحرارة تلقائيًا.
من أين تأتي الطاقة في التفاعلات الماصة للحرارة؟
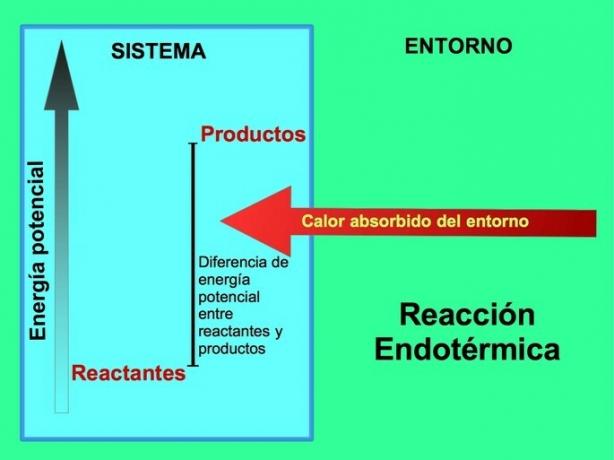
في التفاعلات الماصة للحرارة ، تأتي الطاقة من البيئة خارج النظام. كمية الطاقة الكامنة للمنتجات أكبر من الطاقة الكامنة للمواد المتفاعلة. لذلك ، من الضروري إضافة طاقة إلى المواد المتفاعلة حتى يستمر التفاعل. هذه الطاقة تأتي من حرارة البيئة.
على سبيل المثال، التمثيل الضوئي هو عملية ماصة للحرارة، حيث تلتقط النباتات الطاقة الشمسية لإنتاج الجلوكوز من ثاني أكسيد الكربون والأكسجين:

تحتوي منتجات تفاعل التمثيل الضوئي ، الجلوكوز والأكسجين ، على قدر أكبر من الطاقة الكامنة فيما يتعلق بالمواد المتفاعلة وثاني أكسيد الكربون والماء. أمثلة أخرى للتفاعلات الكيميائية الماصة للحرارة مع كمية الطاقة المستخدمة:

أمثلة على التفاعل الماص للحرارة
لا تحدث التفاعلات فقط في معمل الكيمياء. على أساس يومي ، نجد أيضًا مواقف تحدث فيها تفاعلات ماصة للحرارة.
طهي الطعام
على الرغم من أن عملية طهي الطعام قد لا تبدو كذلك ، إلا أنها ماصة للحرارة. من أجل استهلاك أطعمة معينة ، يجب أن نوفر الحرارة.
كيس بارد فوري
تمتلئ الكمادات الباردة المستخدمة لعلاج النتوءات أو الالتواءات بالماء ، ولكن عندما تهتز أو تطرق ، تتكسر كبسولة تحتوي على نترات الأمونيوم. يعتبر خلط نترات الأمونيوم بالماء تفاعل ماص للحرارة ، مما يؤدي إلى تبريد الكيس.
قد تكون مهتمًا برؤية ملف الفرق بين الحرارة ودرجة الحرارة.
ما هو رد الفعل الطارد للحرارة؟
أ التفاعل الطارد للحرارة هو التفاعل الذي تتدفق فيه الطاقة خارج النظام. يتم إطلاق هذه الطاقة على شكل حرارة ، لذا فإن وضع مقياس حرارة في نظام التفاعل يزيد من درجة الحرارة.
كلمة "طاردة للحرارة" تتكون من exo وهو ما يعني "الخارج" و الحرارة ، وهو ما يعني "الحرارة". يمكن أن تحدث التفاعلات الطاردة للحرارة تلقائيًا وفي بعض الحالات تكون متفجرة ، مثل مزيج الفلزات القلوية والماء.
من أين تأتي الطاقة في التفاعلات الطاردة للحرارة؟
في تفاعل كيميائي ، المتفاعلات هي المركبات التي تتحول وتنتج نواتج. على سبيل المثال ، عندما يتفاعل الصوديوم Na مع الكلور Cl ، فهذه هي المواد المتفاعلة والمنتج هو كلوريد الصوديوم NaCl:

كل من المواد المتفاعلة والمنتجات قد خزنت الطاقة الكامنة. نحن نعلم من لEY حفظ الطاقة هذه الطاقة لا تضيع ولا تكتسب ، لذا يجب أن تكون طاقة المواد المتفاعلة مساوية لطاقة المنتجات.
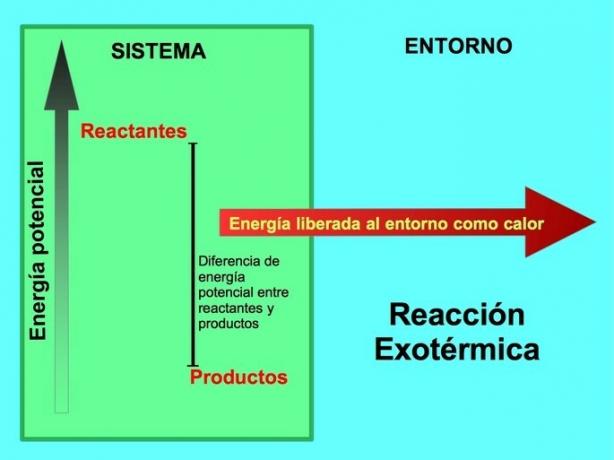
في تفاعل طارد للحرارة ، لالمواد المتفاعلة لديها طاقة كامنة أكبر مقارنة بالمنتجات، لذلك يتم إطلاق الطاقة الزائدة على شكل حرارة. في هذه الحالة ، تعتبر الطاقة أيضًا جزءًا من المنتجات:

في أي عملية طاردة للحرارة ، يتم تحويل جزء من الطاقة الكامنة المخزنة في الروابط الكيميائية إلى طاقة حرارية من خلال الحرارة.
أمثلة على التفاعل الطارد للحرارة
منظفات الغسيل
عندما نذوب القليل من مسحوق الغسيل بالماء في أيدينا ، نشعر بتسخين طفيف.
احتراق الغاز المنزلي
يتضمن احتراق الغازات للاستخدام المنزلي ، مثل الميثان أو البوتان ، تفاعلًا كيميائيًا مع الأكسجين مع تكوين ثاني أكسيد الكربون والماء ، وإطلاق الطاقة. هذا هو رد فعل طارد للحرارة نموذجي في الاستخدام اليومي:
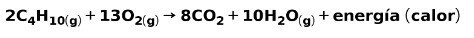
تُستخدم الطاقة المنبعثة في عملية الاحتراق في طهي الطعام.
قد تكون مهتمًا أيضًا بمعرفة ماهيتهم نظام مفتوح ونظام مغلق ونظام معزول.


