الفرق بين الأحماض والقواعد القوية والضعيفة (مع أمثلة)
يعتمد تصنيف الأحماض والقواعد في الكيمياء على قوة التأين لهذه المواد في الوسط المائي. أ) نعم:
- أ حمض وقاعدة قوية عندما تتأين تمامًا ، أي في عملية التأين ، يتم تحويلها بالكامل إلى كاتيونات أو أيونات موجبة وإلى أنيونات أو أيونات سالبة.
- من ناحية أخرى، الحمض والقاعدة ضعيفان عندما تتأين جزئيًا في الماء ، أي في المحلول ستكون هناك نسبة من الكاتيونات ونسبة أخرى من الأنيونات ونسبة أخرى من الجزيئات غير المرتبطة.
| أحماض وقواعد قوية | أحماض وقواعد ضعيفة | |
|---|---|---|
| تعريف | المواد التي تتأين بالكامل في المحلول. | المواد التي تتأين جزئيا في المحلول. |
| التأين | اكتمال | جزئي |
| عناصر في محلول مائي | الكاتيونات والأنيونات في نفس التركيز. | الكاتيونات والأنيونات والجزيئات بنسب مختلفة. |
| ثابت التأين | مرتفع | القليل |
| أمثلة |
|
|
أحماض وقواعد قوية
أ يكون الحمض أو القاعدة قويًا عندما ينفصلان تمامًا في وسط مائيبمعنى آخر ، اكتملت عملية التأين وسيحتوي المحلول على نفس تركيز الأنيونات والكاتيونات.
كيف تقوم بتأين حامض وقاعدة قوية؟
يتأين حمض قوي ، مثل حمض الهيدروكلوريك حمض الهيدروكلوريك بالطرق التالية:
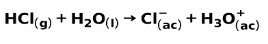
تتأين قاعدة قوية ، مثل هيدروكسيد الصوديوم NaOH بالطرق التالية:
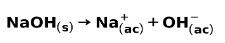
أمثلة على الأحماض القوية وصيغها
| أحماض قوية | معادلة |
|---|---|
| حامض الهيدروكلوريك | حمض الهيدروكلوريك |
| حامض الكبريتيك | ح2جنوب غرب4 |
| حمض النيتريك | HNO3 |
| حمض الهيدروبروميك | HBr |
| حمض البيركلوريك | HClO4 |
| حمض الكروم | ح2CrO4 |
| حمض التيترافلوروبوريك | HBF4 |
أمثلة على القواعد القوية وصيغها
| قاعدة قوية | معادلة |
|---|---|
| هيدروكسيد الصوديوم | هيدروكسيد الصوديوم |
| هيدروكسيد الليثيوم | LiOH |
| هيدروكسيد البوتاسيوم | KOH |
| هيدروكسيد الروبيديوم | RbOH |
| هيدروكسيد السيزيوم | CsOH |
| هيدروكسيد الكالسيوم | كاليفورنيا (يا)2 |
| هيدروكسيد الباريوم | با (يا)2 |
| هيدروكسيد السترونشيوم | الأب (أوه)2 |
| هيدروكسيد الألومنيوم | آل (أوه)3 |
قد تكون مهتمًا برؤية المزيد أمثلة على الأحماض والقواعد.
أحماض وقواعد ضعيفة
أ يكون الحمض أو القاعدة ضعيفًا عندما يتأين جزئيًا في محلول مائي، أي أنه يوجد في المحلول أيونات وجزيئات غير مؤينة.
كيف تقوم بتأين حامض وقاعدة ضعيفة؟
حمض ضعيف مثل حامض الخليك CH3COOH ، يتأين بالطريقة التالية:
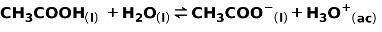
يتم التعبير عن توازن هذا التفاعل بواسطة السهمين في اتجاهين متعاكسين.
عندما ينفصل أو يتأين حمض ضعيف ، يتم إنشاء توازن بين الأنواع الموجودة في المحلول ؛ يمكن التعبير عن هذا بواسطة أ ثابت التأينحامض:
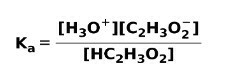
إن ثابت التأين ليس أكثر من النسبة بين مضاعفة تركيز النواتج على مضاعفة تركيز المواد المتفاعلة.
قاعدة ضعيفة ، مثل NH أمونيا3، يتأين بالطريقة التالية:
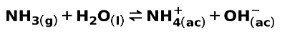
عندما تنفصل قاعدة ضعيفة أو تتأين ، يتم إنشاء توازن بين الأنواع الموجودة في المحلول ؛ يمكن التعبير عن هذا بواسطة أ ثابت التأين الأساسي:
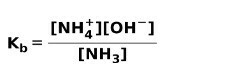
قد تكون مهتمًا بمعرفة الفرق بين الأحماض والقواعد.
أمثلة على الأحماض الضعيفة بصيغتها وثابت التأين الحمضي كل
| حمض ضعيف | معادلة | ثابت التأين |
|---|---|---|
| حمض الفورميك | ح2كو2 | 1.77 × 10-4 |
| حمض الاسيتيك | ح3CCOH | 1.75 × 10-5 |
| حمض الهيدروسيانيك | HOCN | 3.30 × 10-4 |
| سيانيد الهيدروجين | HCN | 6.20 × 10-10 |
| حمض تحت الكلور | HOCl | 3.50 × 10-8 |
| حمض النيتروز | HNO2 | 4.00 × 10-4 |
| حمض اللاكتيك | HC3ح5أو3 | 1.40 × 10-4 |
| حمض الكربونيك | ح2كو3 |
4.30 × 10-7 5.60 × 10-11 |
| حمض البوريك | ح3بو3 |
5.80 × 10-10 1.80 × 10-13 3.00 × 10-14 |
أمثلة على القواعد الضعيفة بصيغتها وثابت التأين الأساسي Kب
| قاعدة ضعيفة | معادلة | ثابت التأين |
|---|---|---|
| الأمونيا | نيو هامبشاير3 | 1.75 × 10-5 |
| ميثيلامين | CH3نيو هامبشاير2 | 4.38 × 10-4 |
| إيثيل أمين | ج2ح5نيو هامبشاير2 | 5.60 × 10-4 |
| الأنيلين | ج6ح5نيو هامبشاير2 | 3.80 × 10-10 |
| بيريدين | ج5ح5ن | 1.70 × 10-9 |
| بنزيلامين | ج7ح9ن | 2.20 × 10-5 |
| بيكربونات الصوديوم | ناهكو | 2.00 × 10-4 |
قد تكون مهتمًا بمعرفة المزيد عنها خصائص الأحماض والقواعد



