خصائص الأحماض والقواعد: الاختلافات الرئيسية
خصائص الأحماض والقواعد هي كل تلك الخصائص والصفات التي يمكننا من خلالها التمييز بين الحمض والقاعدة.
وفقًا لنظرية Arrehnius ، فإن أ حامض هي مادة تطلق البروتونات H+ عندما يذوب في الماء ، و يتمركز هي أي مادة تطلق أيونات الهيدروكسيل OH- عندما تكون في محلول مائي.
| الأحماض | القواعد | |
|---|---|---|
| تشكيل أيون | الحالي | الحالي |
| تفاعل التعادل | عندما يتفاعل مع القاعدة. | عندما يتفاعل مع حمض. |
| الذوبان في الماء | قابل للذوبان | قابل للذوبان جزئيا. هيدروكسيدات الكالسيوم والباريوم والألمنيوم ضعيفة الذوبان. |
| الموصلية الكهربائية | الحالي | الحالي |
| حالة المادة | صلبة أو سائلة أو غازية | صلبة أو سائلة أو غازية |
| رد فعل مع ورق عباد الشمس | تلوين أحمر | تلوين أزرق |
| قيمه الحامضيه | أقل من 7 سنوات | أكبر من 7 |
| النظير المتقارن | يشكل الحمض الضعيف قاعدة مترافقة. | تشكل القاعدة الضعيفة حمضًا مترافقًا. |
| تأثير أكالة | أحماض قوية | قواعد قوية |
خصائص الأحماض
للأحماض العديد من الخصائص التي يمكن التعرف عليها.
القدرة على تكوين أيونات من الأحماض
السمة الرئيسية للمواد الحمضية هي أنها يمكن أن تتأين ، أي تفقد أو تكتسب الإلكترونات.
حمض الهيدروكلوريك حمض الهيدروكلوريك ، حمض قوي ، يتأين لتشكيل كلوريد الأنيون Cl- والبروتون H.+.
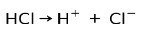
تفاعل التعادل
يتفاعل الحمض مع القاعدة لتكوين ملح وماء. يُعرف رد الفعل هذا باسم تفاعل التعادل. على سبيل المثال ، يتفاعل حمض الهيدروكلوريك مع هيدروكسيد الصوديوم لتكوين كلوريد الصوديوم كلوريد الصوديوم (ملح المطبخ) والماء:
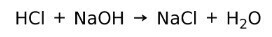
ذوبان الأحماض في الماء
الأحماض قابلة للذوبان في الماء بشكل عام. على سبيل المثال ، حمض الهيدروكلوريك أو حمض المرياتيك قابل للذوبان بشكل معتدل في الماء ، ويمكن إذابة ما يصل إلى 82 جم من حمض الهيدروكلوريك في 100 مل من الماء عند صفر درجة مئوية. في حالة حامض الكبريتيك H2جنوب غرب4يولد المزيج بالماء حرارة ، لذلك ينصح دائمًا بإضافة الحمض إلى الماء لتجنب الانفجارات.
القوة الحمضية
تحدد كيفية تفكك الأحماض ما إذا كانت قوية أم ضعيفة. يتم إعطاء قوة الحمض من خلال التفكك ثابت.
حمض النيتريك HNO3 انه حامض قوي لأنه في محلول مائي يتأين تمامًا إلى بروتونات وأيونات نترات:

هذا يعني أنه عندما نضيف HNO3 في الماء ، عند تحليل الماء سنجد فقط H+ وأيونات النترات ، وتقريباً لا يوجد HNO3.
بدلاً من ذلك ، فإن حمض الأسيتيك الموجود في الخل هو أ حمض ضعيف، لأن جزء منه فقط مفصول:
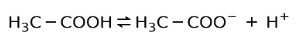
هذا هو السبب في أنها ممثلة بأسهم في اتجاهين ، وهذا يعني أنه في محلول مائي سيكون لدينا حمض أسيتيك ، H+ وأنيون الأسيتات (H3C-COO-).
حالات مادة الأحماض
يمكن العثور على الأحماض في حالة سائلة أو صلبة أو غازية. على سبيل المثال ، حمض الهيدروكلوريك حمض الهيدروكلوريك سائل ، كبريتيد الهيدروجين هو غاز ، وحمض الأكساليك مادة صلبة.
تفاعل مع ورق عباد الشمس من الأحماض

عندما نضع شريطًا من ورق عباد الشمس في مادة حمضية ، يتحول لون ورق عباد الشمس إلى اللون الأحمر.
تحديد الأحماض من خلال الرقم الهيدروجيني
PH هو قياس كمية H.+ موجودة في الحل. وهكذا ، بين الرقم الهيدروجيني 0 و 7 ، نحن في وجود حمض. على سبيل المثال ، الخل له أس هيدروجيني يساوي 2 ، ودرجة حموضة حامض الكبريتيك في بطاريات السيارات تساوي 1.
الموصلية الكهربائية للأحماض
نظرًا لأن الأحماض يمكن أن تنفصل وتنتج أيونات مشحونة كهربائيًا ، فإن المحاليل الحمضية يمكنها توصيل الكهرباء. على سبيل المثال ، داخل بطاريات السيارات ، يستخدم حمض الكبريتيك ، وهو حمض قوي ، كموصل للكهرباء.
تأثير أكالة للأحماض القوية
الأحماض القوية لها تأثير أكالة ، يمكنها حرق الأنسجة العضوية لذلك يجب أن يكون التعامل معها بحذر شديد.
تشكل الأحماض الضعيفة نظيرًا مترافقًا
عندما تذوب ، تشكل الأحماض الضعيفة ما يعرف بالزوج المترافق ، أي أن الحمض الضعيف يشكل قاعدة مترافقة.
على سبيل المثال:

في هذه الحالة ، يشكل حمض الفورميك أو الميثانويك (HCOOH) ، عند فصله ، تنسيق أيون القاعدة المترافق.
قد يثير اهتمامك:
- الأحماض والقواعد القوية والضعيفة.
- أمثلة على الأحماض والقواعد.
خصائص القواعد
بعد ذلك نقدم خصائص القواعد أو المحاليل القلوية التي تميزها.
قدرة التأين الأساسية
تتميز المواد الأساسية أو القلوية بتكوين أيونات عند إذابتها في الماء:

في هذه الحالة ، يتأين هيدروكسيد الصوديوم NaOH ليشكل أنيون هيدروكسيد OH- وكاتيون الصوديوم نا+.
تتفاعل القاعدة مع حمض لتشكيل ملح
تتفاعل القاعدة مع حمض في تفاعل معادل لتكوين ماء وملح ، على سبيل المثال:

في هذه الحالة ، فإن هيدروكسيد الألومنيوم Al (OH)3، وهي قاعدة ، تتفاعل مع حمض الهيدروكلوريك وتشكل ملح كلوريد الألومنيوم AlCl3 و الماء. يستخدم هيدروكسيد الألومنيوم كمضاد للحموضة لتخفيف ارتجاع المعدة عن طريق تحييد الحمض الذي تنتجه المعدة.
قواعد الذوبان في الماء
بعض القواعد قابلة للذوبان في الماء. هيدروكسيدات الأرض القلوية ، مثل هيدروكسيد الكالسيوم وهيدروكسيد الباريوم ، ضعيفة الذوبان في الماء. على سبيل المثال ، يمكن إذابة هيدروكسيد الصوديوم أو الصودا الكاوية 109 جم في 100 مل من الماء عند درجة حرارة 20 درجة مئوية. بينما هيدروكسيد المغنيسيوم أو حليب المغنيسيا Mg (OH)2 انه عمليا لا يذوب في الماء.
قوة القاعدة
اعتمادًا على درجة تأين القاعدة ، يمكن أن تكون قوية أو ضعيفة. على سبيل المثال ، هيدروكسيد الليثيوم هو أ قاعدة قوية لأنه في محلول مائي يتأين تمامًا إلى أيونات هيدروكسيد OH وكاتيونات الليثيوم Li+:
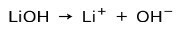
من ناحية أخرى ، الأمونيا NH3 هو قاعدة ضعيفة لأنه عندما تتلامس مع الماء ، لا تتفكك الأمونيا كلها:
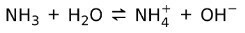
حالة مسألة القواعد
يمكن العثور على القواعد في الحالات الصلبة والسائلة والغازية. على سبيل المثال ، هيدروكسيد الصوديوم النقي صلب ، والأمونيا غاز.
رد فعل مع ورقة عباد الشمس من القواعد
عندما نضع شريطًا من ورق عباد الشمس في مادة قلوية ، يتحول لون الورق إلى اللون الأزرق.
تحديد القواعد من خلال درجة الحموضة الخاصة بهم
تتميز القواعد بوجود درجة حموضة بين 7 و 14.
 التوصيل الكهربائي للقواعد
التوصيل الكهربائي للقواعد
تعتبر القواعد بسبب قدرتها على التأين موصلات جيدة للكهرباء. على سبيل المثال ، في البطاريات القلوية ، يتم استخدام هيدروكسيد البوتاسيوم KOH كموصل كهربائي.
تأثير تآكل القواعد
القواعد القوية يمكن أن تلحق الضرر بالأنسجة العضوية. على سبيل المثال ، تعتبر منظفات أفران المطبخ قواعد قوية بشكل عام ، ويوصى دائمًا بالتعامل معها بحذر شديد ، وارتداء القفازات وحماية العين.
تشكل القواعد الضعيفة نظيرًا مترافقًا
تشكل القواعد الضعيفة عند إذابتها نظيرًا مترافقًا ، أي أن القاعدة الضعيفة تشكل حمضًا مترافقًا.
على سبيل المثال ، tris- (hydroxymethyl) amino methane (OHCH2)3CNH2 هي قاعدة ضعيفة حمضها المترافق هو (OHCH2)3CNH3+:
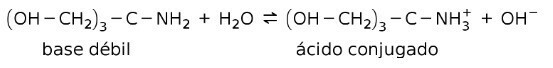
هذا هو أساس عمل المواد العازلة أو متعادل، وهي مواد تُستخدم للحفاظ على الرقم الهيدروجيني للمحاليل باستمرار.
قد تكون مهتمًا بمعرفة الاختلافات بين:
- الأحماض والقواعد.
- الكاتيونات والأنيونات


