أنواع الصيغ الكيميائية والأمثلة

المركبات الكيميائية موجودة في جميع الكائنات والكائنات الحية على كوكبنا. عند محاولة معرفة هذه المركبات ، عادةً ما تُستخدم الصيغ التي يمكن أن تكون أكثر أو أقل تعقيدًا ، وتوفر معلومات أكثر أو أقل ، وتسمى الصيغ الكيميائية. في مقال اليوم معلم سنتحدث عن الاختلاف أنواع الصيغ الكيميائية وأمثلة منهم. إذا كنت تريد معرفة المزيد عنها ، فنحن نعلمك هنا!
ال الصيغ الكيميائية نكون التعبيرات الرسومية للعناصر التي ستشكل المركبات الكيميائية الموجودة. تعبر هذه الصيغ عن كمية ونسبة الذرات المختلفة التي تشكل جزءًا من الجزيء و تمثل بعض أنواع الصيغ أيضًا نوع الرابطة الكيميائية التي تربط الاختلاف عناصر. لكل من الجزيئات أو المركبات المعروفة هناك توافق التسمية الكيميائية أنشأها الاتحاد الدولي للكيمياء البحتة والتطبيقية (IUPAC) وفقًا لنوع الصيغة المستخدمة.
الأنواع المختلفة للصيغ الكيميائية الموجودة تقديم أنواع معينة من المعلومات على الرغم من أنها تعمل جميعًا بشكل عام على فهم الطبيعة الكيميائية للمواد التي تتكون منها والتعبير عن ماذا يحدث أثناء تفاعل كيميائي معين ، لأنه في بعض الأحيان يمكن تحويل بعض العناصر أو المركبات إلى الآخرين. لهذا السبب ، تتبع الصيغ الكيميائية أ
النظام التمثيلي للعناصر والجزيئات تحددها لغة فنية متخصصة.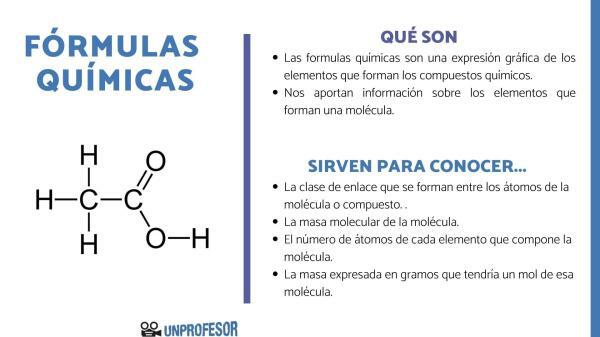
كقاعدة عامة ، بغض النظر عن أنواع الصيغ الكيميائية ، تتكون هذه الصيغ من حوالي رموز كيميائية على شكل حرف التي تمثل نوع من الذرة الذي يشكل الجزيء وفقًا لـ الجدول الدوري للعناصر وبعض الأرقام على شكل حرف منخفض بجوار الرمز الكيميائي الذي يمثل المقدار النسبي في الجزيء.
في بعض مجالات الكيمياء (خاصة في الكيمياء العضوية) توجد بعض المجموعات الكيميائية التي تمتلك التكرار البنيوي والوظيفي في الجزيئات، مما يسمح لنا بتحديد أجزاء معينة من جزيء أو مركب. تسمى شظايا الجزيئات هذه بالجذور الكيميائية (عندما تحتوي على إلكترونات غير مقترنة) أو مجموعات كيميائية. وظيفية (عندما تكون ذرات أو وحدات تجعل المركب يتفاعل أو يتصرف بطريقة معينة) طريقة).
بعض أمثلة على الجذور الكيميائية هم جذر الميثيل (CH3) ، وجذر البروم (Br-) أو جذور الكلور (Cl-). من أمثلة المجموعات الوظيفية مجموعة الكربونيل (CO) أو مجموعة الهيدروكسيل (OH) أو مجموعة الكربوكسيل (COOH).

تستخدم الأنواع المختلفة للصيغ الكيميائية الموجودة رموزًا كيميائية للعناصر التي تتكون منها والنسب المنطقية التي يتم تحديدها فيما بينها ، والتي يتم التعبير عنها بـ الرموز الرياضية. الصيغ الكيميائية المختلفة المستخدمة في التسمية هي كما يلي.
الصيغة الجزيئية
الصيغة الجزيئية هي الصيغة الأساسية عدد الذرات الموجودة ويعبر عن نوع الذرات وعدد كل حاضر في المركب. الصيغة سهلة الكتابة والتفسير ، فهي تقدم ببساطة رموز العناصر الكيميائية وأرقامها في شكل رموز فرعية في شكل تسلسل خطي. فمثلا، لدينا الصيغ التالية:
- الأكاسيد الأساسية: Na2O (أكسيد الصوديوم) ، K2O (أكسيد البوتاسيوم) ، MgO (أكسيد المغنيسيوم).
- هيدروكسيدات: هيدروكسيد الصوديوم (هيدروكسيد الصوديوم) KOH (هيدروكسيد البوتاسيوم) ، Ca (OH) 2 (هيدروكسيد الكالسيوم) ، Mg (OH) 2 (هيدروكسيد المغنيسيوم)
- الأحماض: HCl (حمض الهيدروكلوريك) ، H3PO4 (حمض الفوسفوريك) ، H2SO3 (حامض الكبريتيك) ، H2SO4 (حامض الكبريتيك)
- الأملاح: NaCl (كلوريد الصوديوم) ، Na2SO3 (كبريتيت الصوديوم) ، Na2SO4 (كبريتات الصوديوم)
صيغة شبه مطورة
الصيغة شبه المطورة تشبه الصيغة الجزيئية و يعبر عن الذرات التي يتكون منها المركب ، الروابط الكيميائية على شكل خطوط ونوع الروابط هي تلك التي تربط ذرات المركب (بسيط ، مزدوج ، ثلاثي). ومع ذلك ، في هذا النوع من الصيغة لا يتم تمثيل روابط الكربون والهيدروجين. تستخدم هذه الأنواع من الصيغ على نطاق واسع في تسميات الكيمياء العضوية. أمثلة على هذه الأنواع من الصيغ هي:
- الصيغ شبه المطورة في الكيمياء العضوية: CH3-CH3 (إيثان) ، CH3-CH2-OH (إيثانول)
- الصيغ شبه المطورة في الكيمياء غير العضوية: نادرة ، بعضها PO (OH) 3 (حمض الفوسفوريك) ، (OH) 2P (O) OP (O) (OH) 2 (حمض البيروفوسفوريك)
صيغة مطورة
هذا نوع آخر من الصيغ الكيميائية. إنه أكثر تعقيدًا بقليل من شبه المتطور. في هذا النوع من الصيغة ، يشار إلى الرابطة وكذلك موضع الذرة داخل الجزيء ، مما يمثل بنية المركب في المستوى الديكارتي.
الصيغة الهيكلية
هذا النوع من الصيغة الكيميائية معقد للغاية ، لكنه يوفر قدرًا كبيرًا من المعلومات حول الجزيئات ، التي تمثل ، بالإضافة إلى هيكلها وتنظيمها ، شكلها المكاني في ثنائية أو ثلاثي الأبعاد.
صيغة لويس
هم معروفون أيضا ب مخططات لويس أو هياكل لويس وتشبه الصيغ المطورة ، ولكن في هذه الحالة أيضًا يتم تمثيل الإلكترونات المشتركة في كل رابطة بين الذرات ، والتي يتم تمثيلها بنقاط ملحقة بخطوط الروابط. يتم تمثيل الإلكترونات غير المشتركة أيضًا كنقاط على الذرات. هذه الصيغ تقنية للغاية وتستخدم في مجالات محددة للغاية.


