ВСИЧКИ свойства на ATOM

Изображение: SlideShare
Въпреки че не можем да ги видим с просто око, атомите са част от цялата материя на нашата планета. Цялата материя е изградена от атоми, които се групират заедно, за да образуват химични елементи, молекули, съединения и т.н. Атомът се определя като най-малката основна единица на материя, която има свойствата на химичен елемент. Всеки химичен елемент се определя от вида на атома, от който е изграден, така че последният въпрос е: какви свойства има атомът? В този урок от УЧИТЕЛ ще разгледаме свойства на атома които правят всеки атом характерен химичен елемент.
Индекс
- Какво е атомът?
- Атомно число, масово число и изотопи
- Плътност, друго от свойствата на атома
- Йонен радиус и радиус на Vanderwalls
- Йонизационна енергия
Какво е атомът?
Преди да влезете, за да анализирате свойствата на атома е важно да знаем по-добре за какво става въпрос. The атом е единица, образувана от три субатомни частици: протони, неутрони и електрони. Те са организирани в ядро и кора.
- The ядро Измислено е протони Y. неутрони, който е в центъра на атома и е отговорен за по-голямата част от теглото на атома; протоните са положително заредени, докато неутроните са неутрални, така че ядрото е положително заредено.
- The Кортекс Образува се от електрони, които са малки, отрицателно заредени частици, които се въртят около ядрото, образувайки орбити (като тази на планетите), но без никога да попадат в ядрото на атома. Кората на атома е отговорна за взаимодействието с кората на другите атоми, тъй като тя се намира от външната страна на атомите.
Различните атоми са изградени от протони, неутрони и електрони, еднакви във всички химични елементи. И така, какво прави различните химични елементи? Броят на протоните, неутроните и електроните от които са съставени атомите на всеки елемент е различно и това от своя страна кара всеки елемент да има Характеристика или други.

Изображение: SlideShare
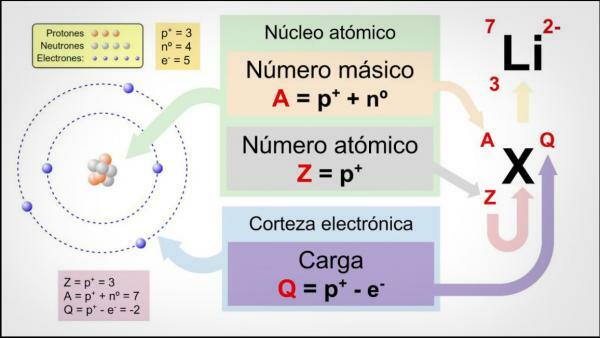
Атомният номер, масовото число и изотопите.
Първите три характеристики са свързани директно с броя на частиците, съставляващи атома на всеки елемент.
The атомен номер (Z) показва броя на протоните, които изграждат ядрото на атома. Така например, всички атоми на желязото ще имат 26 протона в ядрото си. Освен това, ако не ни кажат друго, химичните елементи са в неутрално състояние, т.е. положителният (протони) и отрицателният (електрони) заряд е еднакъв, така че всички те също ще имат 26 електрони.
The масово число или атомно тегло (A) показва общия брой протони и неутрони, които изграждат ядрото на атома. Както вече посочихме по-рано, теглото на електроните е практически незначително в сравнение с това на електроните. протони и неутрони, така че масовото число индиректно показва теглото на въпросния атом. Продължавайки с примера с желязо, ако се консултирате с периодичната таблица на елементите, ще видите, че теглото атомен на този елемент е 55,85, което означава, че всички атоми на този елемент ще имат това тегло.
И накрая, изотопи на химичен елемент са варианти на един и същ атом (т.е. те имат един и същ атомен номер), но различно масово число, т.е. различен брой неутрони. Повечето химически елементи имат повече от един естествен изотоп, като елементът с най-голямо количество стабилни изотопи е калай (Sn), който има 10 различни естествени изотопа.
Изображение: ConceptDefinition.de
Плътност, друго от свойствата на атома.
The плътност на атом е броят единици за маса (u.m.a) на елемента, които присъстват в определен обем пространство. Плътността на всяко вещество е символизирана чрез гръцката буква "Ro" (написано r) и неговите единици според международната система от единици (SI) са килограми на кубичен метър (kg / m3). В случай на химически елементи, тъй като са толкова малки, грамът на кубичен сантиметър (g / cm3).
За да изчислява плътността на атома (атомна плътност), ще трябва да вземем предвид масата на атома и неговия обем. Докато по-голямата част от масата на атома е в ядрото на същия, обемът трябва да направи с това колко е голям атомът и следователно броят на електронните орбитали ще играе роля важно. Като се вземат предвид тези свойства и тяхната тенденция в периодичната система, можем да забележим, че плътността се увеличава с увеличаването на групата и също се увеличава с приближаването до централната част от периодичната таблица.
Изображение: YouTube
Йонен радиус и радиус на Vanderwalls.
The йонен радиус е радиусът, който йонът на даден елемент има в йонното кристално състояние. В това състояние йоните са толкова близо един до друг, че най-външните електронни орбитали са в контакт помежду си.
От друга страна, радиус на стените е разстоянието, което два атома се държат разделени поради отблъскването на отрицателните заряди между електроните на всеки от атомите. Радиусът на Vanderwalls би бил радиус на въображаема твърда сфера, използвана за моделиране на атома, така че не се използва много в ежедневната практика.
За разлика от това, което се случва с плътността или масата, тези две свойства са тясно свързани с обема на атома, тоест те имат повече общо с броя на електроните в него, отколкото с ядро.

Изображение: SlidePlayer
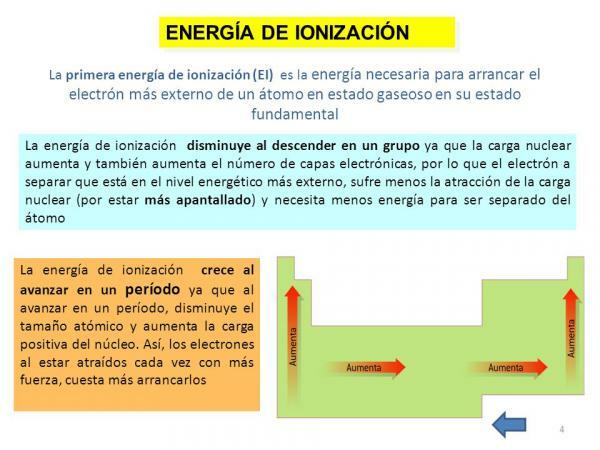
Йонизационна енергия.
И накрая, друго от свойствата на атома е йонизационна енергия, свойство, което ни казва енергията, от която се нуждаем, за да отделим електрон в основното му състояние (различно от анион или катион) на атом на елемент в газообразно състояние, но може да се определи и като силата, с която електронът се свързва с други молекули. Този имот е много интересен, тъй като ни позволява да добием приблизителна представа за способност за реакция на атом от определен химичен елемент. Енергията на йонизация е по-висока, когато премахваме електрони, така че за даден елемент има енергия от първа йонизация, втора йонизационна енергия, и така нататък и те стават все по-големи и по-големи.
Както в предишния случай, това свойство също е тясно свързано с броя на орбиталите на въпросният елемент, тъй като колкото по-малко орбитали има, толкова повече ще струва премахването на електроните от атом решителен.
Изображение: SlidePlayer
Ако искате да прочетете повече статии, подобни на Атомни свойства, препоръчваме да въведете нашата категория на Атомът.

