Основни ХАРАКТЕРИСТИКИ НА ИЗОТОПИТЕ

Изображение: Планети
Цялата материя, която изгражда нашата планета, се състои от атоми. Но всички атоми не са еднакви, атомите на различни елементи имат различен брой протони, неутрони и електрони. Понякога броят на тези субатомните частици не са еднакви, не са балансирани и видове като изотопи. Изотопите са атоми на един и същ елемент (например водород), но които нямат еднакъв брой неутрони. Този "дисбаланс" причинява характеристики на изотопите на един и същи елемент не са равни. В този урок от УЧИТЕЛ ще разгледаме подробно всички тези характеристики. Започнахме!
Индекс
- Какво е изотоп?
- Атомни характеристики на изотопите
- Любопитно приложение на изотопи: изотопно маркиране
- Характеристики на изотопите на същия елемент
Какво е изотоп?
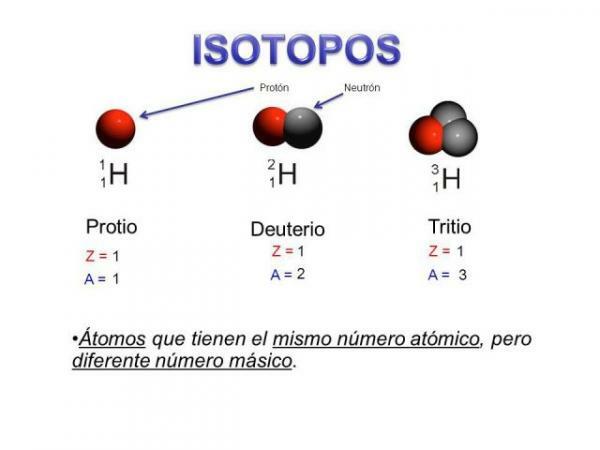
Преди да говорим за характеристиките на изотопите, е важно да знаем по-добре от какво се състои това. субатомна частица. Можем да кажем какви са изотопите са "подгрупи" на атомите: Те са атоми на същия елемент, но които се различават в определени неща.
Изотопите са два атома с еднакъв брой протони (същия атомен номер), но различен брой неутрони (различна атомна маса). Изотопите на същия елемент обикновено се именуват с името на елемента, последвано от атомната му маса. Известно е иl въглерод четиринадесет (C14), който се използва за определяне на възрастта на вкаменелостите, но въглеродът има и други изотопи като въглерод 12 и въглерод 13, които са по-стабилни от другите изотопи на въглерод като въглерод 8 или въглерод въглерод 22.
В нашия случай всички тези атоми са въглеродни атоми, така че имат атомен номер 6 (Z = 6), но въглерод 12 („Нормален“ въглерод) има атомно тегло 12 спрямо атомното тегло 14 на въглерод 14 или атомно тегло 8 въглерод С8.
Тези разлики между различните изотопи могат да причинят атомите да имат различни характеристики, поведение с атоми на други елементи, полуживот и т.н.
Изображение: Вашите задачи
Атомни характеристики на изотопите.
- Първата характеристика на изотопите на атомно ниво е, че всички изотопи са атоми на същия елемент.
- Тази основна характеристика ни води до втора характеристика: всички изотопи на един и същи елемент имат един и същ атомен номер, тоест същия брой протони.
- Всички изотопи на даден елемент имат същия брой протони.
- Изотопите на един и същи елемент имат различен брой неутрони, т.е. различно масово число или атомна маса.

Изображение: EHU
Любопитно приложение на изотопи: изотопно маркиране.
Изотопното етикетиране е техника, която използва две много важни характеристики на изотопите: че всички изотопи реагират по един и същ начин в химична реакция и че някои от тях имат радиоактивност.
По време на химична реакция две или повече вещества, наречени реактиви, те комбинират своите атоми, за да образуват други различни вещества, получени от различни комбинации, така наречените продукти. The изотопна маркировка е техника, чрез която можем да въведем радиоактивния изотоп на реагент в реакцията, така че Това ще реагира по нормален начин и можем да го открием по всяко време благодарение на радиоактивността, която излъчвам.
Други варианти на тази техника ни позволяват да идентифицираме различни изотопи на реагента чрез масова спектрометрия или инфрачервена спектроскопия.

Изображение: Slideplayer
Характеристики на изотопите на същия елемент.
Като следствие от атомните характеристики, видени в предишния раздел, изотопите на един и същи елемент могат да имат и други видове характеристики, които ще опишем по-долу.
- Изотопите на същия елемент имат различна маса. Физически свойства като плътност, които ще бъдат различни за различните изотопи на един и същ елемент.
- Определено химични свойства те зависят от вида на елемента, който е и следователно няма да бъдат различни за различните изотопи на даден елемент. Пример за това е разтворимост, какво ще бъде постоянна за всички изотопи на даден елемент.
- В тясна връзка с тяхното равенство по химични свойства е следната характеристика на изотопите: изотопите на един и същи елемент реагират по същия начин при химични реакции. Това означава, че ако въглеродният 12 атом (най-често срещаният или "нормален" атом) реагира с два кислородни атома За да образуваме молекулата на въглеродния диоксид, ние знаем, че тези на другите изотопи на въглерода също са те ще. Това е много важно свойство за много практически приложения на изотопите и радиоизотопите.
- Изотопите на даден елемент могат да бъдат от естествен или изкуствен произход. Ако въпросният изотоп може да бъде намерен в природата, без ръката на човека да се е намесила в неговото създаване, ние сме изправени пред изотоп естествено, докато ако е създаден в ядрени реактори, ускорители на частици или радиоизотопни генератори, ние казваме, че е изкуствени. един и същ елемент може да има естествени и изкуствени изотопи.
- Изотопите могат да бъдат радиоактивни или нерадиоактивни. Радиоактивните изотопи са тези, при които има излишък от енергия, която атомът има тенденция да елиминира, за да премине от нестабилно състояние в по-стабилно.
- Свързани с предишните характеристики можем да кажем, че изотопите радиоактивен те имат променливо време на живот. Животът е времето, необходимо на изотопа да се разпадне, т.е. да спре да има тази излишна енергия, която го прави нестабилен. Има радиоактивни изотопи, които са много нестабилни и имат време на живот от секунди, докато други отнемат часове или дори години, за да се разпаднат и да станат по-стабилни изотопи. Обикновено изкуствено създадените атоми имат много по-кратък живот или време на разпад от естествените.
Ако искате да прочетете повече статии, подобни на Характеристики на изотопите, препоръчваме да въведете нашата категория на Атомът.
Библиография
- Брисеньо V, Г. (s.f) Изотопи.
- Белмонте, А. (15 май 2019 г.). Свойства на атома.
- Уикипедия (22 октомври 2019 г.). Изотоп.

