Характеристики на киселините и основите: основни разлики
Характеристиките на киселините и основите са всички онези свойства и качества, с които можем да различим между киселина и основа.
Според теорията на Arrehnius, a киселина е вещество, което освобождава протони Н+ когато се разтвори във вода, и a база е всяко вещество, което освобождава хидроксилни йони OH- когато е във воден разтвор.
| Киселини | Основи | |
|---|---|---|
| Образуване на йони | Присъства | Присъства |
| Реакция на неутрализация | Когато реагира с основа. | Когато реагира с киселина. |
| Разтворимост във вода | Разтворим | Частично разтворим. Калциевите, бариевите и алуминиевите хидроксиди са слабо разтворими. |
| Електрическа проводимост | Присъства | Присъства |
| Състояние на материята | Твърди, течни или газообразни | Твърди, течни или газообразни |
| Реакция с лакмусова хартия | Червено оцветяване | Синьо оцветяване |
| Стойност на PH | Под 7 | Повече от 7 |
| Конюгиран аналог | Слабата киселина образува конюгирана основа. | Слаба основа образува конюгирана киселина. |
| Корозивен ефект | Силни киселини | Силни бази |
Характеристики на киселините
Киселините имат няколко характеристики, с които могат да бъдат идентифицирани.
Способност за образуване на йони от киселини
Основната характеристика на киселинните вещества е, че те могат да се йонизират, т.е. да губят или да получат електрони.
Солната киселина HCl, силна киселина, йонизира, образувайки хлориден анион Cl- и протон Н+.
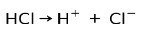
Реакция на неутрализация
Киселината реагира с основа, образувайки сол и вода. Тази реакция е известна като реакция на неутрализация. Например, HCl реагира с NaOH, за да образува натриев хлорид NaCl (кухненска сол) и вода:
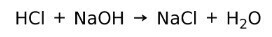
Водоразтворимост на киселини
Киселините обикновено са разтворими във вода. Например, солната киселина или муриатичната киселина са умерено разтворими във вода, до 82 g HCl могат да бъдат разтворени в 100 ml вода при 0 ° C. В случай на сярна киселина Н2ЮЗ4, сместа с вода генерира топлина, така че винаги е препоръчително да добавяте киселината към водата, за да избегнете експлозии.
Киселинна сила
Как дисоциират киселините определя дали те са силни или слаби. Силата на киселината се дава от нейната константа на дисоциация.
Азотна киселина HNO3 това е силна киселина тъй като във воден разтвор той напълно йонизира в протони и нитратни йони:

Това означава, че когато добавяме HNO3 във вода, при анализ на водата ще открием само Н+ и нитратни йони и практически без HNO3.
Вместо това оцетната киселина, която се намира в оцета, е слаба киселина, тъй като само част от него е отделена:
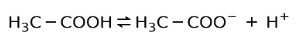
Ето защо е представен със стрелки в две посоки, това означава, че във воден разтвор ще имаме оцетна киселина, Н+ и ацетатен анион (Н3C-COO-).
Състояния на вещество на киселини
Киселините могат да бъдат открити в течно, твърдо или газообразно състояние. Например, солната киселина HCl е течна, сероводородът HS е газ, а оксаловата киселина е твърдо вещество.
Реакция с лакмусова хартия от киселини

Когато поставим лента лакмусова хартия в кисело вещество, лакмусовата хартия става червена.
Идентифициране на киселините по тяхното pH
PH е мярката за количеството H+ присъства в разтвор. По този начин, между pH 0 и 7, ние сме в присъствието на киселина. Например, оцетът има рН, равно на 2, рН на сярна киселина в автомобилните акумулатори е равно на 1.
Електрическа проводимост на киселини
Тъй като киселините могат да се дисоциират и да произвеждат електрически заредени йони, киселинните разтвори могат да провеждат електричество. Например, в автомобилните акумулатори сярна киселина, която е силна киселина, се използва като проводник на електричество.
Корозивен ефект на силни киселини
Силните киселини имат корозивен ефект, те могат да изгорят органични тъкани, така че боравенето с тях трябва да бъде изключително внимателно.
Слабите киселини образуват конюгиран аналог
Когато се разтварят, слабите киселини образуват така наречената конюгатна двойка, т.е. слабата киселина образува конюгирана основа.
Например:

В този случай мравчена или метанова киселина (HCOOH), когато се дисоциира, образува конюгирания основен йон.
Това може да ви заинтересува:
- Силни и слаби киселини и основи.
- Примери за киселини и основи.
Характеристика на основите
След това представяме свойствата на основите или алкалните разтвори, които ги характеризират.
Базов йонизационен капацитет
Основните или алкални вещества се характеризират с образуване на йони при разтваряне във вода:

В този случай натриевият хидроксид NaOH йонизира, образувайки хидроксиден анион OH- и натриев катион Na+.
Основата реагира с киселина, за да образува сол
Базата реагира с киселина в реакция на неутрализация, за да образува вода и сол, например:

В този случай алуминиевият хидроксид Al (OH)3, основа, реагира с HCl и образува алуминиево-хлоридна сол AlCl3 и вода. Алуминиевият хидроксид се използва като антиацид за облекчаване на стомашния рефлукс чрез неутрализиране на киселината, произведена от стомаха.
Основа на разтворимост във вода
Някои основи са разтворими във вода. Алкалоземните хидроксиди, като калциев хидроксид и бариев хидроксид, са слабо разтворими във вода. Например натриевият хидроксид или содата каустик могат да се разтворят 109 g в 100 ml вода при 20 ° C. Докато магнезиев хидроксид или магнезиево мляко Mg (OH)2 практически е неразтворим във вода.
Основна якост
В зависимост от степента на йонизация на основата, те могат да бъдат силни или слаби. Например, литиевият хидроксид е a здрава основа тъй като във воден разтвор той напълно йонизира в хидроксидни йони OH и литиеви катиони Li+:
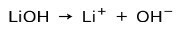
От друга страна, амоняк NH3 е слаба база защото когато влезе в контакт с вода, не всички амоняци се дисоциират:
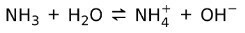
Състояние на основите
Основите могат да бъдат намерени в твърдо, течно и газообразно състояние. Например чистият натриев хидроксид е твърдо вещество, амонякът е газ.
Реакция с лакмусова хартия на основите
Когато поставим лента лакмусова хартия в алкално вещество, хартията става синя.
Идентифициране на основите по тяхното pH
Основите се характеризират с рН между 7 и 14.
 Електрическа проводимост на основите
Електрическа проводимост на основите
Основите поради техния йонизационен капацитет са добри проводници на електричество. Например в алкалните батерии калиев хидроксид КОН се използва като електрически проводник.
Корозивен ефект на основите
Силните основи могат да увредят органичните тъкани. Например почистващите препарати за кухненски фурни обикновено са силни основи и винаги се препоръчва да се борави с тях изключително внимателно, да се носят ръкавици и предпазни очила.
Слабите основи образуват конюгиран аналог
Слабите основи при разтваряне образуват конюгиран аналог, т.е. слабата основа образува конюгирана киселина.
Например трис- (хидроксиметил) аминометан (OHCH2)3CNH2 е слаба основа, чиято конюгирана киселина е (OHCH2)3CNH3+:
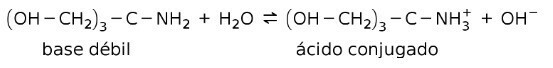
Това е основата за действието на буферни вещества или буфер, които са вещества, които се използват за постоянно поддържане на рН на разтворите.
Може да ви е интересно да знаете разликите между:
- Киселини и основи.
- Катиони и аниони


