DEFINICE kladných nebo záporných iontů

Jak již víme, atomy jsou tvořeny subatomární částice. Ze tří typů subatomárních částic nemají pouze neutrony žádný elektrický náboj. Místo toho mají protony kladný elektrický náboj, zatímco elektrony záporný náboj. Pouze elektrony, které zabírají periferii atomu, lze přenést z jednoho atomu na druhý, zatímco protony v jádře si udržují stabilní počet. V této lekci UČITELE uvidíme, co se stane, když atomy nebo molekuly získají nebo ztratí elektrony. To znamená, že uvidíme definice a příklady kladných nebo záporných iontů.
Index
- Co jsou ionty? Snadná definice
- Tvorba iontů: elektroafinita a elektronegativita
- Co jsou záporné ionty? S příklady
- Co jsou kladné ionty? S příklady
Co jsou ionty? Snadná definice.
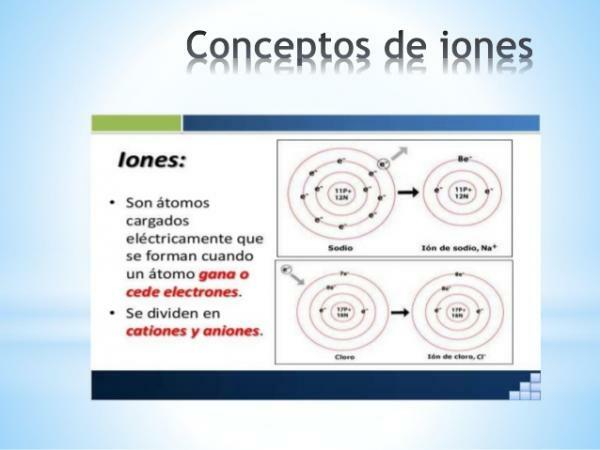
A ion je jakýkoli atom nebo molekula se síťovým elektrickým nábojem. To znamená, že se jedná o atom nebo sadu atomů spojených dohromady, jejichž elektrické náboje nejsou kompenzovány. K této dekompenzaci nábojů dochází, když se jeden nebo více elektronů spojí nebo opustí atom nebo sadu atomů.
Ionty jsou tedy nabité atomy nebo molekuly, v důsledku zisku nebo ztráty elektronů (subatomární částice se záporným nábojem a zanedbatelnou hmotností).
Typy iontů: monatomické a polyatomické
Pokud vezmeme v úvahu složení iontů, rozlišujeme dva typy: monatomické ionty a polyatomické ionty.
- Jak název napovídá, monatomické ionty ty, které jsou tvořeny a jediný atom.
- Iontové sloučeniny o polyatomové ionty jsou atomy, ve kterých jsou atomy kovalentně vázány (sdílejí jeden nebo více párů elektronů ve vazbě) a představují řadu neutrony v molekule odlišné od celkového počtu elektronů.
- The polyatomové ionty obvykle obsahují kyslík a obvykle mají strukturu s centrálním atomem, kolem kterého jsou uspořádány zbývající prvky, které tvoří molekulu.
- The náboj monatomových iontů reprezentativních prvků (rodiny 1 a 2 tabulky a rodiny 13 až 17 periodické tabulky) lze snadno odvodit, pokud je známo jejich umístění v periodické tabulce. V těchto případech atomy získávají nebo ztrácejí elektrony, aby ve své valenční skořápce dosáhly konfigurace vzácného plynu své doby (s2p6), nebo co je stejné, splnit oktetové pravidlo.
Obrázek: Prezentace
Tvorba iontů: elektroafinita a elektronegativita.
Schopnost atomů nebo molekul tvoří ionty je dána dvěma periodickými vlastnostmi: elektroafinita a elektronegativita. Obě vlastnosti zvyšují hodnotu za určité období a snižují se, když sestupujeme přes skupinu nebo rodinu periodické tabulky.
The elektroafinita, také nazývaná elektronová afinita, je atomová vlastnost, která je definována jako schopnost atomu přitahovat elektrony. V případě sloučenin se podobná vlastnost nazývá elektronegativita což je definováno jako schopnost atomu přitahovat elektrony, když vytváří vazbu s jiným atomem. Obě vlastnosti tak definují tendenci prvku zachytit nebo ztratit elektrony.
Iontové vazby
V pevné formě tvoří ionty sloučeniny nebo iontové krystaly (soli), vytvořené kombinací iontů různých znamének spojených dohromady pomocí iontové vazby. Nejznámějším příkladem tohoto typu sloučeniny je běžná sůl (chlorid sodný: NaCl).
Iontová vazba se skládá z svazků iontů odlišného znaménka pomocí elektrostatických přitažlivých sil (přitažlivost mezi náboji opačného znaménka). Do tohoto typu spojení zasahují prvky, jejichž elektronegativita nebo elektroafinita je velmi odlišná (kovové a nekovové prvky). Ve většině případů tyto iontové sloučeniny jsou rozpustný ve vodě a další polární rozpouštědla.
Ve vodných roztocích se iontové sloučeniny disociují na volné ionty, které se nazývají elektrolyty, protože jeho přítomnost v roztoku způsobuje, že se voda chová jako elektrický vodič.
Co jsou záporné ionty? S příklady.
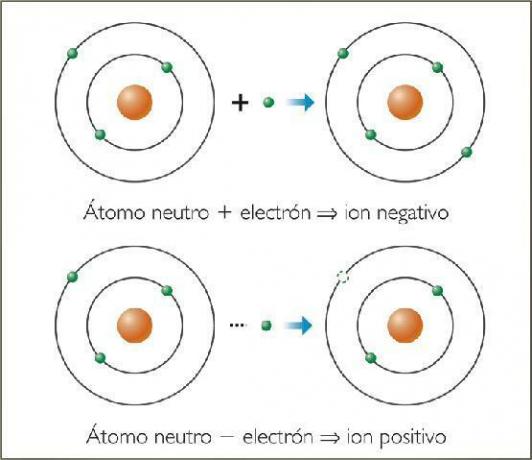
The záporné ionty Se nazývají anionty. Ve všech případech se jedná o atomy nekovových prvků nebo molekuly, které obsahují nekovové prvky. Tyto prvky se vyznačují velmi vysokou elektroafinitou a elektronegativitou. To znamená, že jsou to ionty tvořené prvky s vysoká tendence k zachycení elektronů.
Monatomické anionty: definice a příklady
Jsou to anionty tvořené atomy nekovových prvků (skupiny 13 až 17 periodické tabulky), které získaly jeden nebo více elektronů. Tyto anionty mají společnou elektronickou strukturu ušlechtilého plynu (y2p6) ve svém nejvzdálenějším elektronovém obalu (valenční obal).
Příklady:
- Chloridový ion: Cl-
- Fluoridový iont: F-
- Jodidový ion: I-
- Sulfidový iont: S-2
- Nitridový iont: N-3
Polyatomické anionty: definice a příklady
Jsou to záporně nabité ionty tvořené dvěma nebo více atomy nekovových prvků spojených kovalentními vazbami. Jsou to nejběžnější polyatomové ionty. Nejběžnějšími polyatomovými anionty jsou oxoanionty, které jsou tvořeny centrálním nekovovým atomem a obsahují kyslík.
Obecně se považují za chemické sloučeniny získané, když kyselá sloučenina ztratí jeden nebo více protonů (H+). Tyto polyatomové anionty mohou ve své struktuře zadržovat určitý vodík, což jim dává určitý kyselý charakter (schopnost vzdát se protonů).
Příklady:
- Dusičnanový iont: NO3-
- Permanganátový ion: MnO4-
- Fosfátový ion: PO4-3
- Ion hydrogenuhličitanu nebo hydrogenuhličitanu: HCO3-
- Siřičitanový ion: SO3-2
Obrázek: Naturopatie
Co jsou kladné ionty? S příklady.
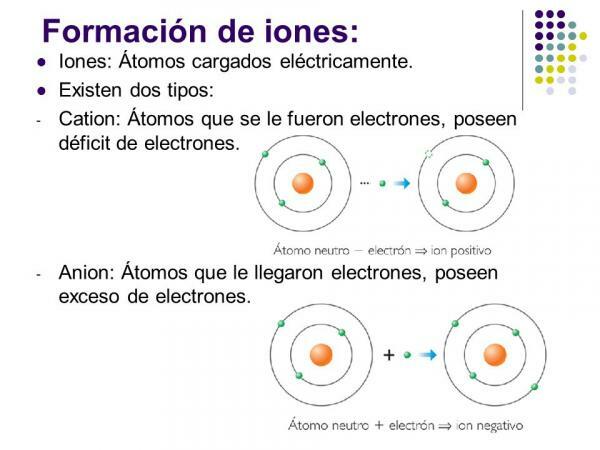
Kladné ionty se nazývají Cace. Téměř ve všech případech jsou to atomy kovových prvků nebo molekuly, které obsahují kovové prvky. Tyto prvky se vyznačují velmi nízkou elektroafinitou a elektronegativitou, a proto vykazují jasnou tendenci ke ztrátě elektronů.
Monatomické kationty: definice a příklady
Jsou to ionty s kladným nábojem (v důsledku ztráty elektronů) tvořené jediným atomem kovového prvku. V tomto případě je kation vytvořen ztrátou elektronů, které umožňují prvku vyprázdnit jeho nejvzdálenější elektronovou vrstvu a získat konfiguraci vzácného plynu (s2p6) z nižší úrovně. Jsou nejběžnějším typem kationtů.
Příklady:
- Vodíkový nebo hydronový kation (také nazývaný proton): H+
- Sodný kation: Na+
- Kation železnatý nebo železitý: Fe+3
- Vápníkový kation: Ca+2
- Měď (II) nebo měďnatý kation: Cu+2
Polyatomové kationty: definice a příklady
Polyatomové kationty jsou ty, které jsou tvořeny dvěma nebo více atomy. Jsou vzácné, nejhojnější jsou takzvané homopolyatomické kationty, které obsahují více než jeden atom stejného prvku, v případě trihydrogenového iontu je to jedna z nejhojnějších molekul v vesmír. Polyatomické kationty tvořené atomy různých prvků nejsou běžné, ale jsou charakterizovány přítomnost vodíku a předpokládá se, že vzniká, když bazická sloučenina zachytí proton (H+).
Příklady:
- Amonný kation: NH4+
- Oxoniový kation: HO3+
- Fosfoniový kation: PH3+
- Trihydrogenový kation nebo protonovaný molekulární vodík: H3+
- Dimertuční kation: Hg2+2
Obrázek: Planety
Pokud si chcete přečíst více podobných článků Negativní a pozitivní ionty: definice a příklady, doporučujeme zadat naši kategorii Atom.
Bibliografie
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Základní chemie. Madrid: Uned
