Rozdíl mezi sklem a křišťálem
Sklo je materiál vytvořený člověkem kombinací a fúzí minerálů při vysokých teplotách, což vede k průhlednému, křehkému, tvrdému a tvarovatelnému vedlejšímu produktu.
Krystal je veškerá pevná látka přítomná v přírodě vytvořená chemickými procesy, které vytvářejí krystalickou mřížku, což je uspořádaná a symetrická struktura atomů a molekul.
Rozdíl mezi sklem a křišťálem je v tom, že sklo je tvořeno lidským zásahem, zatímco krystal je způsob, jakým jsou atomy a molekuly těl seskupeny pevný.
| Sklenka | Krystal | |
|---|---|---|
| Definice | Amorfní a tvarovatelný materiál vytvořený fúzí sloučenin při vysokých teplotách. | Pevný materiál vzniklý při procesu krystalizace. |
| Zdroj |
|
Nachází se v přírodě. |
| Typy |
|
|
| Příklady |
|
|
| Jak se recykluje |
Skleněný odpad jde do zeleného koše. |
Pokud máte na mysli olovnaté sklo, které se běžně říká „křišťál“, nelze jej recyklovat. Odpad olovnatého skla jde do šedé nádoby. |
Co je to sklo?

Sklo je pevný a amorfní materiál, vytvořený fúzí sloučenin, jako je oxid křemičitý (SiO2), uhličitan sodný (Na2CO3) a uhličitan vápenatý (CaCO3), mezi ostatními.
V přírodě lze sklo nalézt:
- Jako obsidián, jasná, silná a ostrá hornina získaná ochlazením sopečné lávy.
- Jak tektiky, což jsou brýle z meteoritů, které zasáhly Zemi a které jsou díky svému původu velmi vzácné.
Použití skla v jeho přirozené formě není tak běžné a omezuje se na zpracování ornamentálních předmětů, proto je mnohem více populární sklo vyrobené člověkem.
Na druhé straně je průmyslové sklo rozděleno do několika typů v závislosti na jeho chemickém složení.
Druhy skla a jejich použití
K dispozici jsou 4 druhy skla, podle složek, z nichž je vyrobeno.
Sodno-vápenaté sklo

Skládá se z vápníku, sodíku a oxidu křemičitého. Taví se velmi snadno, a proto se jedná o nejlevnější druh skla na trhu.
Po dlouhou dobu se doporučovalo vyhnout se sodno-vápenatému sklu pro výrobu žáruvzdorných nádob pro gastronomické použití, protože netolerovalo změny teploty a rozbíjelo se. Tato vlastnost však byla upravena začleněním většího množství oxidu křemičitého, což mu dává větší odolnost.
Příklad sodno-vápenatého skla lze nalézt v automobilovém skle.
Olovnaté sklo

Jedná se o sklo, které se vyrábí nahrazením olova za sodík a vápník. Je velmi snadné ho roztavit a roztáhnout, což znamená, že se roztaví při roztavení. Má také žáruvzdornou a UV absorpční kvalitu.
Olovnaté sklo se často nazývá olovnatý křišťál nebo jednoduše křišťál. Toto je však pouze komerční, protože sklo není krystalická struktura, proto skleněné předměty neexistují.
V každodenním životě je olovnaté sklo přítomno ve sklenicích, sklenicích nebo nádobí.
Borosilikátové sklo

Skládá se z oxidu křemičitého a oxidu boritého. Neroztaví se tak snadno, má velkou žáruvzdornou kapacitu a jeho expanzní kapacita je omezená, proto se používá k výrobě laboratorní a kuchyňské materiály, protože odolávají vysokým teplotám, aniž by se roztahovaly a nehrozilo riziko úrazu šokem tepelný.
Příkladem aplikace borosilikátového skla jsou žáruvzdorné podnosy a nádoby.
Křemičité sklo

Je to nejobtížnější tavení skla, protože jsou vyžadovány velmi vysoké teploty (více než 1 500 ° C) a také velmi sofistikované a nákladné techniky pro jeho transformaci na konečný produkt.
Příklady křemičitého skla lze vidět na objektech, které vyžadují dlouhodobé vystavení vysokým teplotám, jako jsou vložky do pecí nebo laboratorní trubky.
Co je to krystal?

Krystal je pevná, průhledná struktura s uspořádaným, symetrickým molekulárním uspořádáním a pravidelnou geometrií. Má hojnou povahu a je tvořen krystalizací, procesem, při kterém atomy nebo molekuly vytvářejí vazby a vytvářejí elementární jednotku zvanou jednotková buňka, struktura ve tvaru krychle nebo rovnoběžnostěnu.
V každodenním životě se výrazem „křišťál“ označuje olovnaté sklo, které se používá při výrobě předmětů, jako jsou brýle a poháry. Tento název je nesprávný, protože sklo je materiál s asymetrickou a neuspořádanou molekulární strukturou, jedná se tedy o dva různé materiály.
Jednotkové buňky jsou rozděleny do různých skupin na základě jejich charakteristik. Tyto skupiny jsou známé jako krystalové systémy.
Krystalické systémy
Podle délky stran jednotkové buňky, uspořádání jejích os a úhlů jsou krystaly rozděleny do sedmi velkých krystalových systémů.
1. Krychlový systém
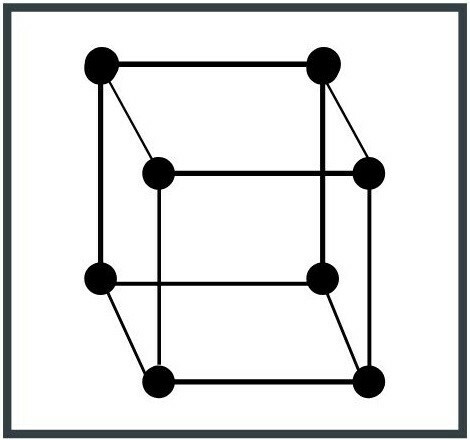
Jednotková buňka má tvar krychle. Jedná se o nejjednodušší konfiguraci systému a jednu z nejběžnějších v přírodě. Příklady kubických krystalových systémů jsou železo (Fe) a měď (Cu).
2. Tetragonální systém
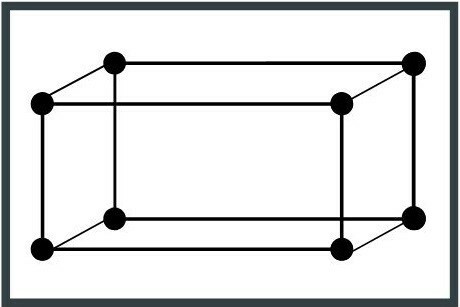
Jednotková buňka má tvar rovnoběžnostěnu, což má za následek postavu s tříosou základnou s úhly 90 stupňů. Příkladem tetragonálního krystalového systému je oxid manganatý (Mn4+NEBO2).
3. Ortorombický systém
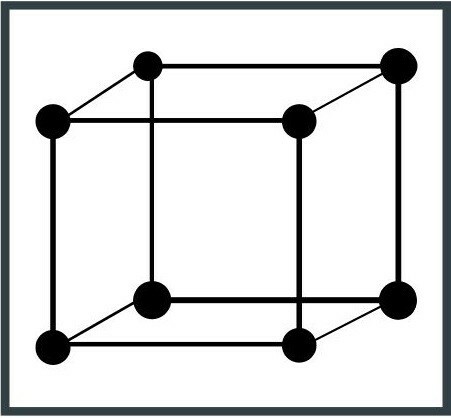
Jednotková buňka má tvar podlouhlé krychle se třemi pravými úhly a třemi hranami (segmenty, které omezují plochy krychle) s různými délkami. Topaz je minerál, který patří do této krystalové soustavy.
4. Šestihranný systém
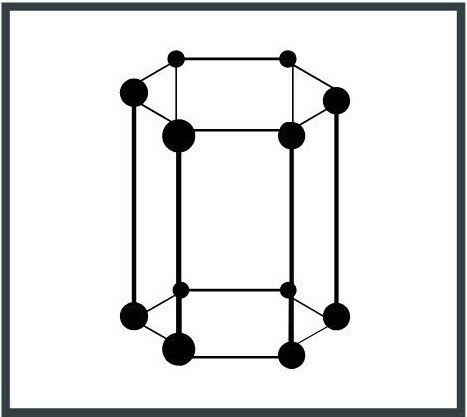
Jednotková buňka má základnu šestiúhelníku a symetrii hranolu se třemi osami 120 °. Příkladem hexagonálního systému je grafit, jedna z forem, ve kterých se uhlík (C) vyskytuje v přírodě.
5. Romboedrický systém

Jednotková buňka má tři pravé úhly a tři stejné hrany. Rubín je příkladem trigonálního krystalového systému.
6. Monoklinický systém
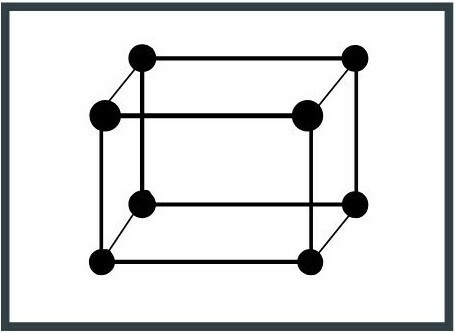
Jednotková buňka má dvě 90 ° osy a její okraje mají různé délky. Slída je minerál, který má tuto konfiguraci.
7. Triclinický systém
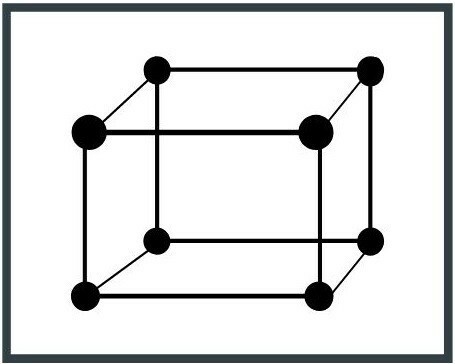
Jednotková buňka má tři nerovné osy a také jejich délky. Příkladem triclinického systému je albit (NaAlSi3NEBO8), minerál ze skupiny silikátů.
Jak se recykluje sklo a křišťál?

I když se s nimi zachází jako se synonymy, jsou sklo a křišťál dva různé prvky. Sklo je materiál vzniklý fúzí různých sloučenin, jako je oxid křemičitý, zatímco sklo je molekulární strukturou.
Recyklace skla
Recyklace skla spočívá ve využití skleněného odpadu k jeho přeměně na surovinu pro výrobu nových produktů. Chcete-li tak učinit, musíte postupovat podle těchto kroků:
- Klasifikace: sklo je klasifikováno podle jeho typu (pokud jde o sodík, olovo, borosilikát atd.)
- Oddělení: po zařazení je sklo odděleno od jakéhokoli jiného materiálu, který nebyl dříve zlikvidován (malé kousky plastu, kovu atd.)
- Rozdrcený a roztavený- Čisté sklo se drtí a taví společně s dalšími sloučeninami, jako je sodík, vápenec a oxid křemičitý k získání suroviny, která bude použita při vývoji nových produktů z sklenka.
Sklenice vhodné k recyklaci jsou ty, které pocházejí z lahví, nádob a sklenic a jsou uloženy v zelených nádobách. Laminované, rozbité sklo žárovky nebo lampy nelze recyklovat a jde do šedé nádoby.
Recyklace skla
Když hovoříte o recyklaci skla, máte na mysli recyklaci olovnatého skla. V takovém případě nelze předměty vyrobené z tohoto materiálu recyklovat a jdou v šedém kontejneru.
Recyklace „křišťálového“ nebo olovnatého skla v zelených nádobách způsobuje vážné poškození životního prostředí. Olovo je sloučenina, která je zdraví škodlivá, a pokud není řádně oddělena v recyklačních centrech, končí v tavicích pecích. Tam bude smíchán s dalšími skleněnými zbytky, s nimiž budou později vyrobeny lahve nebo jiné předměty.



