Atomstruktur og egenskaber

Billede: SlidePlayer
Atomer er en del af vores verden. Al materie er lavet af atomer, så det er vigtigt at forstå bedre, hvad de består af, og hvad deres funktioner er. I denne lektion fra en LÆRER vil vi fortælle dig hvad struktur af et atom og egenskaber. Hvis du vil vide mere om de partikler, der udgør alt, skal du fortsætte med at læse denne artikel.
Indeks
- Hvad er atomer?
- Atomstruktur
- Atomets vigtigste egenskaber
- Hvad er isotoper?
- Hvordan findes atomerne i naturen?
Hvad er atomer?
Det atom det er den mindste enhed, i hvilken stof kan opdeles uden at miste sine kemiske egenskaber, det vil sige dets egenskaber som et kemisk element. Atomet er oprindelsen til alt, hvad der kan ses eller berøres, fra stjernerne til din morgenmad i morges.
Hvis vi lægger bort tabet af dets kemiske egenskaber, kan vi sige, at atomet består af forskellige partikler, kaldet subatomære partikler. Der er tre typer subatomære partikler -protoner, neutroner og elektroner- med forskellige egenskaber.
Disse partikler er grupperet i forskellige tal for at danne de kemiske grundstoffer (ilt, kulstof osv.), Men de fordeles altid efter en fast struktur.

Billede: Google Sites
Atomstruktur.
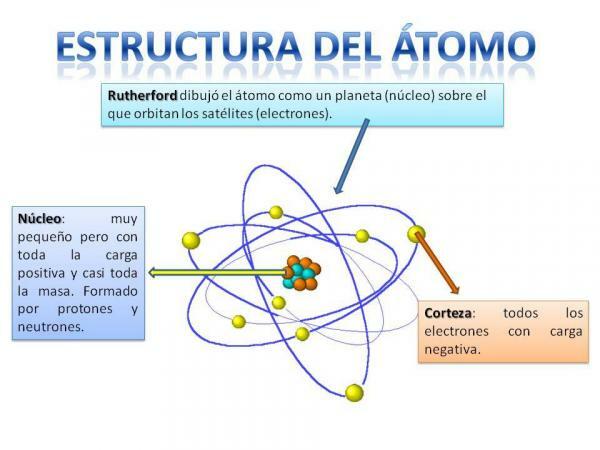
Atomstrukturen er fast, det vil sige, at vi kan have forskellige typer atomer (hydrogenatom, iltatom osv.), men deres subatomære partikler er altid organiseret på samme måde som et planetarisk system.
Du vil helt sikkert huske, hvordan solsystemet er organiseret: Solen er i centrum og omkring herfra roterer planeterne og beskriver forskellige baner, nogle tættere og andre mere fjernt fra Sol. I tilfælde af atomer, i midten er kerne, med en form svarende til en brombær og består af neutroner og protoner.
Omkring kernen er Cortex hvilket er det område, gennem hvilket elektroner. Tidligere troede man, at elektroner beskrev visse baner, svarende til hvordan planeter gør, selvom det nu er ved, at disse baner ikke er så veldefinerede og mere ligner områder, hvor vi er mere tilbøjelige til at befinde os elektroner.
Billede: REA - Plan Ceibal
Atomets vigtigste egenskaber.
For at fortsætte med denne lektion om atomets struktur og egenskaber er det vigtigt at fokusere på de elementer, der får et atom til at blive betragtet som sådan.
Og til dette er vi nødt til at besvare dette spørgsmål: Hvorfor beslutter alle atomer at bestille sig selv på den bestemt måde? Svaret er simpelt: det skyldes elektriske tiltrækningskræfter. Atomens kerne består af neutroner, der ikke har nogen elektrisk ladning, og protoner, som har en positiv elektrisk ladning. og elektronerne har en negativ elektrisk ladning, så der er en lignende tiltrækningskraft mellem kernen og elektronerne produceret mellem de to poler af en magnet, men er ikke stærk nok til, at elektroner "falder" til kerne.
Dette forstås bedre, hvis vi tager højde for kernestørrelse: hvis atomet for eksempel havde dimensionen af et fodboldstadion, ville kernen have dimensionen af bolden i midten fra marken Hvor meget attraktiv kraft fodbolden skulle have for at stadionblegere kunne falde på den!
Funktionen af neutroner
Nu undrer du dig måske, og hvilken rolle spiller neutroner? På trods af at de ikke har en elektrisk ladning, har neutroner en stor rolle inden for atomet: de bidrager med 99% af massen. Hvis det hjælper dig med at huske, kan vi sige, at et atom er som en bande på tre venner: det tunge neutron, den positive proton og den negative elektron, som går rundt om neutronen og elektron.
Elektroners bevægelse
På dette tidspunkt vil jeg have os til at gå tilbage til noget, som vi havde efterladt i blækhuset: banerne, som elektronerne beskriver omkring kernen. Vi havde sagt det elektroner drejer sig om kernen som planeterne gør omkring solen, nogle nærmere end andre, hvorfor gør de det? Elektroner roterer i en eller anden skal i henhold til den energi, de har til at bevæge sig væk fra kernen, det vil sige de elektroner, der er tættere på kernen, ikke har tilstrækkelig kraft til at bevæge sig væk fra kernen, mens de i yderste lag (orbitaler) i skorpen har mere energi og har været i stand til at bevæge sig længere væk fra kernen. kerne. Desuden er der i hver af orbitalerne en maksimal kapacitet på 8 elektroner (oktetregel).
Partiklerne i et atom
Vi kommer tilbage til en anden tilgang, som vi tidligere har gjort, men ikke har forklaret: atomer består af neutroner, protoner og elektroner, som altid kombinerer efter samme struktur af kerne og skorpe, men de gør det i forskellige tal for at danne de forskellige kemiske grundstoffer. Hvordan kan vi få så mange elementer, der kun kombinerer 3 typer partikler? De kemiske grundstoffer, som du nogensinde har set repræsenteret i det periodiske system, er karakteriseret ved at have et bestemt atomnummer.
Det atomnummer (Z) Det fortæller os antallet af protoner i kernen af denne type atom, hvilket er lig med antallet af elektroner under normale forhold. Således vil for eksempel alle atomer, der har 6 protoner (Z = 6), være carbonatomer, og de vil have de samme kemiske egenskaber; atomer med 5 protoner (Z = 5) vil være boratomer med samme kemiske egenskaber som hinanden og forskellige fra kulstofatomer. Du behøver ikke at forveksle atomnummer med atomvægt eller masse nummer (A), som er summen af vægten af neutroner og protoner (vægten af elektronerne er ubetydelig med hensyn til vægten af den samlede kerne).

Billede: SlidePlayer
Hvad er isotoper?
I naturen kan vi finde forskellige "undertyper" af elementer, den isotoper. Jeg er sikker på, at du på et tidspunkt har hørt om kulstof 14, en radioaktiv isotop af kulstof, der blandt andet bruges til at bestemme fossilernes alder. Isotoper er to atomer med det samme antal protoner (det samme atomnummer), men forskelligt antal neutroner (forskellig atommasse). Isotoperne af det samme element er normalt navngivet med navnet på elementet efterfulgt af dets atommasse.
I vores eksempel er begge isotoper kulstof, så de har et atomnummer på 6 (Z = 6) men carbon 12 (“normalt” carbon) har en atomvægt på 12 mod atomvægten af carbon 14 14. Isotoperne af det samme element har meget lignende kemiske og fysiske egenskaber. I tilfælde af kulstof 14 er det i modsætning til kulstof 12 en radioaktiv isotop, der er til stede i alle grundstoffer, der indeholder kulstof, inklusive levende væsener.
Og med dette afslutter vi denne lektion om atomets struktur og egenskaber. Vi håber, det har været til hjælp for dig.

Billede: Dine opgaver
Hvordan findes atomerne i naturen?
Atomer kan findes isoleret, men det mest normale er at finde dem kombineret i grupper hedder molekyler.
Molekyler kan bestå af atomer af det samme element (såsom iltmolekylet, der består af to atomer af ilt) eller ved grupper med atomer af forskellige grundstoffer (to atomer hydrogen og et ilt danner molekylet af Vand). Disse grupper af grundstoffer kaldes molekyler, som igen kan kombineres med hinanden og danner forskellige mere og mere komplekse grupper efter deres reaktivitet og deres kemiske affinitet for kilde til kemiske forbindelser.
Hvis du vil læse flere artikler, der ligner Atomstruktur og egenskaber, anbefaler vi, at du indtaster vores kategori af Atomet.
