Hvad er KEMISKE FORMLER, og hvad er de til [RESUMÉ + VIDEOER]
Selvom det ikke ser ud til, de kemiske grundstoffer i det periodiske system De omgiver os på alle sider. Men mange gange findes de ikke separat, men danner snarere molekyler eller makromolekyler af forskellige kemiske grundstoffer. Kemiske formler er det grafiske udtryk for disse forbindelser og bruges til at standardisere deres nomenklatur. I denne lektion fra en LÆRER vil vi se hvad er kemiske formler og hvad er de til. Slut dig til os for at finde ud af mere!
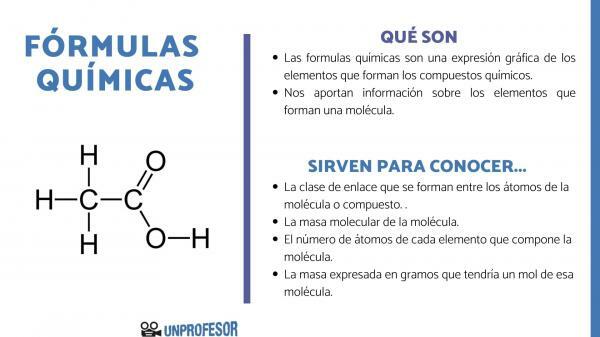
Det kemiske formler er et grafisk udtryk for de elementer, der udgør kemiske forbindelser.
Disse kemiske formler er ikke vilkårlige, men følger nogle strenge regler af kemisk nomenklatur, fastsat af IUPAC (International Union of Pure and Applied Chemistry).
Kemiske formler giver os også information om elementer, der udgør et molekyle, således fortæller den os for eksempel antallet og de respektive proportioner af hvert af de atomer, der udgør det, og nogle gange endda typen af Kemisk binding der eksisterer mellem disse elementer.
Hvert molekyle eller makromolekyle, der eksisterer, svarer til dets kemiske formel, uanset hvor det er
forskellige former for formler. Hver af disse typer giver os forskellige oplysninger om molekylet, men de hjælper os alle til at forstå det kemisk natur og det hjælper os med at forstå, hvad der sker i kemiske reaktioner, og hvordan en forbindelse kan omdannes til andre.Men for at forstå denne kemiske nomenklatur er det nødvendigt at have en vis viden i kemi, da de adlyder et ret specialiseret teknisk sprog.

Billede: Slideplayer
Det kemiske formler er repræsenteret af forening af kemiske symboler, med det tilsvarende bogstav for hvert atom, som det kommer i periodiske system, og subscripts, som er tal, der repræsenterer mængden af disse atomer i molekylet
Inden for kemi (både organisk og uorganisk) er der visse fragmenter eller forbindelser, der viser en vis gentagelse både strukturel og funktionel og identificeres ved navne bestemt. Når disse fragmenter har frie elektroner, der ikke deles, kaldes de radikaler, og de er ustabile, meget reaktive forbindelser med en kort halveringstid.
Eksempler på radikale er methylgrupper CH3, nitratgrupper NO3, hydroxylgrupper OH- eller radikalet Cl-. Imidlertid er de kendt som funktionelle grupper, når de er atomer eller grupper af atomer knyttet til en kæde kuldioxid (med forskellige kul), og som er ansvarlige for reaktiviteten og kemiske egenskaber ved molekyler.
Disse grupper er især vigtige inden for organisk kemi (menneskelige biomolekyler er grundlæggende kulstof og brint). Nogle eksempler på funktionelle grupper er carbonylgruppen = C = O eller carboxylgruppen - COOH.

Billede: Monogramas.com
Som vi sagde, der er flere typer kemiske formler. Hver af disse formler giver os en anden type information om molekylerne og derfor det tjener et bestemt formål, uden at nogen formel er bedre eller værre end en anden i generelle termer.
Klasserne af kemiske formler, som vi skelner er:
Empiriske formler
Empiriske formler er de enkleste formler til at repræsentere et kemisk molekyle, nogle gange siger, at de er minimale formler. Disse formler repræsenterer andelen af atomerne i hvert af grundstofferne i molekylet, som er forenklet til hele tal, altid de mindste. Et eksempel på denne formel er CH3 (methylgruppe), med tre hydrogenatomer og et carbonatom.
Disse formler kan dog nogle gange give misforståelser om sammensætningen af molekylet. Dette sker, når formlen ikke angiver det faktiske antal atomer i molekylet, som med peroxid hydrogen, hvis empiriske formel er H2O, når formlen skal være H2O2 (to atomer af hydrogen og to af ilt). Dette sker således gennem en nomenklaturkonvention, da begge abonnenter er lige store, forenkles de.
Nogle forbindelser kan dog kun repræsenteres med empiriske formler, da de består af ionnetværk. Dette sker for eksempel i almindeligt salt eller natriumchlorid, som er repræsenteret som NaCl, hvilket indikerer, at der for hvert natrium er et klor.
Molekylære formler
Disse typer formler er ret grundlæggende, de udtrykker simpelthen typen af atomer og antallet af hver til stede i et kovalent molekyle. De er formler, der præsenterer de kemiske grundstoffer og tallet på en lineær måde (i form af et underskrift. Et eksempel på denne formler er, når glukose hedder C6H12O6, hvilket udtrykker den glukose Glucosemolekyle består af seks kulstofatomer, tolv brintatomer og seks af ilt.
Molekylære formler er meget brugt, nogle gange siger, at de er de sande formler for molekyler. I mange tilfælde falder de sammen med de empiriske formler, for eksempel i CO2.
Halvudviklede formler
Halvudviklede formler er en form for formler, der ligner molekylære formler, da de også udtrykker de atomer, der udgør molekylet og deres antal, men også give oplysninger om kemiske bindinger (repræsenteret ved linjer mellem atomer) og typen af binding mellem de kulstofatomer, der danner den (hvis de er simple, dobbelte eller tredobler). Den semi-udviklede formel er nyttig til at identificere de radikaler, der udgør molekylet og dets kemiske struktur (bindingerne mellem carbon- og brintatomerne er ikke repræsenteret).
I tilfælde af glukose er dens semi-udviklede formel CH2OH - CHOH - CHOH - CHOH -CHOH - CHO, og som det kan ses, er atomerne af carbon, hydrogen og oxygen er de samme som i molekylformlen (henholdsvis seks, tolv og seks) og alle enkeltbindinger (glukose har kun bindinger) enkel). Denne formel er derfor en mere kompleks formel end den molekylære formel.
Halvudviklede formler kaldes nogle gange kondenserede og er måske den mest udbredte klasse af formler. bruges, især i organisk kemi, selvom de ikke tillader os at observere molekylernes virkelige geometri.
Udviklet formel
De udviklede formler er en smule mere komplekse end de semi-udviklede. I denne type formler er bindingen og placeringen af hvert atom i molekylet repræsenteret i et kartesisk plan, indtil hele forbindelsen er repræsenteret.
Strukturel formel
Strukturformlen er en grafisk fremstilling af strukturen af molekylet i rummet, der giver os information om rækkefølgen og fordelingen af atomer i rummet. I denne formel er de kemiske bindinger, der udgør molekylet, også vist, og om de er enkelt, dobbelt eller tredobbelt. Denne formel er derfor den, der giver os mest information om molekylet.
Disse typer formler bruges mere på et professionelt niveau inden for kemiens verden, da de gør det muligt at se meget tydeligere de kemiske reaktioner eller syntese af nye molekyler.
Lewis formler
Det er komplekse, meget specifikke og tekniske formler. De er også kendt som Lewis-diagrammer eller strukturer og ligner de udviklede formler for molekyler, men Derudover er de elektroner, som atomerne deler i hver kemisk binding, angivet, som varierer med atomernes valens involveret.
I disse formler er bindingerne mellem atomer repræsenteret ved linjer (som også angiver, om de er enkelt, dobbelt eller tredobbelt) eller med et par prikker. De solitære elektroner eller elektroner, der ikke er delt i bindingen, er repræsenteret af punkter omkring det atom, som det svarer til.

Billede: Organisk kemi
Når man skriver formler, henvises der nogle gange tiloxidationstal af grundstoffet (det er hyppigt i ioniske forbindelser). Disse er et sæt positive og negative tal, der går forbundet med hvert element.
- Oxidationstallene kan fortolkes som antal elektroner at et grundstof deler en kovalent binding eller overfører i en ionbinding.
- Når oxidationstegnet over atomet er negativ, betyder, at dette grundstof fanger elektroner, og det antal, der ledsager det ved siden af, er antallet af opfangede elektroner. Derfor betyder en oxidationstilstand på -1, at grundstoffet opfanger en elektron, -2, der optager to, og så videre.
- Når tegnet på oxidation er positiv, atomet afgiver en elektron, og tallet, der ledsager dette tegn, er antallet af opgivet elektroner. På samme måde betyder en oxidationstilstand på +1, at den giver én elektron, +2, at den giver to, og så videre.
Dette virker mest for ioniske forbindelser, i kovalente bindinger, selvom fortolkningen er ens, er den ikke den samme, da disse bindinger deler elektroner. I disse forbindelser taler vi om mere elektronegative grundstoffer, som trækker mere af det elektroniske par og efterlades med en mere negativ ladning, afhængigt af antallet af elektroner, det tiltrækker. Dette kan ses i Lewis formler.
Hvis du vil vide, hvad kemiske formler er til, skal du tage højde for, at dette tal giver os mulighed for at få nogle molekyle information, som de er:
- Det link klasse der dannes mellem atomerne i molekylet eller forbindelsen. Disse bindinger er normalt kovalente, når ikke-metalliske og ioniske atomer deltager i det, hvis de er metalliske og ikke-metalliske bindinger.
- Det molekylær masse af molekylet.
- Det antal atomer af hvert grundstof, der udgør molekylet. Det kaldes undertiden den centesimale sammensætning af molekylet.
- Massen udtrykt i gram der ville have et mol af det molekyle.
I tilfælde af en ionforbindelse, for eksempel natriumchlorid eller almindeligt salt, er det strengt taget ikke korrekt tale om molekyler (selv om det nogle gange gøres), at disse har tendens til at danne store aggregater og makromolekyler. I dette tilfælde hjælper formlen for forbindelsen os med at se, hvilke ioner der danner den og i hvilken mængde.
