Eigenschaften von Säuren und Basen: Hauptunterschiede
Die Eigenschaften von Säuren und Basen sind all jene Eigenschaften und Eigenschaften, mit denen wir zwischen einer Säure und einer Base unterscheiden können.
Nach der Theorie von Arrehnius ist a Acid ist eine Substanz, die Protonen H. freisetzt+ wenn in Wasser gelöst, und a Base ist jede Substanz, die Hydroxylionen freisetzt OH- wenn in wässriger Lösung.
| Säuren | Basen | |
|---|---|---|
| Ionenbildung | Vorhanden | Vorhanden |
| Neutralisierungsreaktion | Wenn es mit einer Base reagiert. | Wenn es mit einer Säure reagiert. |
| Wasserlöslichkeit | Löslich | Teilweise löslich. Calcium-, Barium- und Aluminiumhydroxide sind schwer löslich. |
| Elektrische Leitfähigkeit | Vorhanden | Vorhanden |
| Aggregatszustand | Fest, flüssig oder gasförmig | Fest, flüssig oder gasförmig |
| Reaktion mit Lackmuspapier | Rote Färbung | Blaue Färbung |
| PH Wert | Unter 7 | Größer als 7 |
| Gegenstück konjugieren | Eine schwache Säure bildet eine konjugierte Base. | Eine schwache Base bildet eine konjugierte Säure. |
| Korrosive Wirkung | Starke Säuren | Starke Basen |
Eigenschaften von Säuren
Säuren haben mehrere Merkmale, mit denen sie identifiziert werden können.
Fähigkeit, aus Säuren Ionen zu bilden
Das Hauptmerkmal saurer Substanzen ist, dass sie ionisiert werden können, dh Elektronen verlieren oder aufnehmen.
Salzsäure HCl, eine starke Säure, ionisiert zu Chloridanion Cl- und Proton H+.
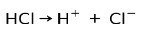
Neutralisierungsreaktion
Eine Säure reagiert mit einer Base zu einem Salz und Wasser. Diese Reaktion ist bekannt als Neutralisierungsreaktion. HCl reagiert beispielsweise mit NaOH zu Natriumchlorid NaCl (Küchensalz) und Wasser:
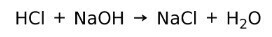
Wasserlöslichkeit von Säuren
Säuren sind im Allgemeinen in Wasser löslich. Salzsäure oder Salzsäure ist beispielsweise in Wasser mäßig löslich, bis zu 82 g HCl können in 100 ml Wasser bei 0 °C gelöst werden. Bei Schwefelsäure H2SW4, die Mischung mit Wasser erzeugt Wärme, daher ist es immer ratsam, dem Wasser die Säure zuzusetzen, um Explosionen zu vermeiden.
Säurestärke
Wie Säuren dissoziieren, bestimmt, ob sie stark oder schwach sind. Die Stärke einer Säure wird durch ihre Dissoziationskonstante.
Salpetersäure HNO3 es ist ein starke Säure weil es in wässriger Lösung vollständig in Protonen und Nitrationen ionisiert:

Dies bedeutet, dass wenn wir HNO. hinzufügen3 im Wasser finden wir bei der Analyse des Wassers nur H+ und Nitrationen und praktisch kein HNO3.
Stattdessen ist die in Essig enthaltene Essigsäure a schwache Säure, weil nur ein Teil davon dissoziiert ist:
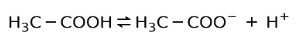
Deshalb wird es mit Pfeilen in zwei Richtungen dargestellt, dies bedeutet, dass wir in wässriger Lösung Essigsäure haben, H+ und das Acetatanion (H3C-COO-).
Aggregatzustände von Säuren
Säuren kommen in flüssigem, festem oder gasförmigem Zustand vor. Salzsäure HCl ist beispielsweise flüssig, Schwefelwasserstoff HS ist ein Gas und Oxalsäure ist ein Feststoff.
Reaktion mit Lackmuspapier aus Säuren

Wenn wir einen Streifen Lackmuspapier in eine saure Substanz legen, wird das Lackmuspapier rot.
Identifizierung von Säuren anhand ihres pH-Wertes
PH ist das Maß für die Menge an H+ in einer Lösung vorliegen. Somit befinden wir uns zwischen pH 0 und 7 in Gegenwart einer Säure. Essig hat beispielsweise einen pH-Wert von 2, der pH-Wert von Schwefelsäure in Autobatterien beträgt 1.
Elektrische Leitfähigkeit von Säuren
Da Säuren dissoziieren und elektrisch geladene Ionen erzeugen können, können saure Lösungen Elektrizität leiten. In Autobatterien wird beispielsweise Schwefelsäure, eine starke Säure, als Stromleiter verwendet.
Ätzende Wirkung starker Säuren
Starke Säuren wirken ätzend, sie können organisches Gewebe verbrennen, daher ist bei ihrer Handhabung äußerste Vorsicht geboten.
Schwache Säuren bilden ein konjugiertes Gegenstück
Schwache Säuren bilden beim Auflösen ein sogenanntes konjugiertes Paar, dh eine schwache Säure bildet eine konjugierte Base.
Beispielsweise:

In diesem Fall bildet Ameisen- oder Methansäure (HCOOH), wenn sie dissoziiert ist, das konjugierte Basen-Ionen-Format.
Es könnte Sie interessieren:
- Starke und schwache Säuren und Basen.
- Beispiele für Säuren und Basen.
Eigenschaften der Basen
Als nächstes stellen wir die Eigenschaften der Basen oder alkalischen Lösungen vor, die sie charakterisieren.
Basenionisationskapazität
Basische oder alkalische Stoffe zeichnen sich dadurch aus, dass sie in Wasser gelöst Ionen bilden:

In diesem Fall ionisiert das Natriumhydroxid NaOH, um ein Hydroxid-Anion OH form zu bilden- und ein Natriumkation Na+.
Eine Base reagiert mit einer Säure zu einem Salz
Eine Base reagiert mit einer Säure in einer Neutralisationsreaktion zu Wasser und einem Salz, zum Beispiel:

In diesem Fall ist das Aluminiumhydroxid Al (OH)3, eine Base, reagiert mit HCl und bildet das Aluminiumchloridsalz AlCl3 und Wasser. Aluminiumhydroxid wird als Antazida verwendet, um den Magenreflux zu lindern, indem die vom Magen produzierte Säure neutralisiert wird.
Basiert die Wasserlöslichkeit
Einige Basen sind wasserlöslich. Erdalkalihydroxide, wie Calciumhydroxid und Bariumhydroxid, sind in Wasser schlecht löslich. Natriumhydroxid oder Natronlauge können beispielsweise 109 g in 100 ml Wasser bei 20 °C gelöst werden. Während Magnesiumhydroxid oder Magnesiamilch Mg (OH)2 es ist in Wasser praktisch unlöslich.
Basisstärke
Je nach Ionisationsgrad der Base können diese stark oder schwach sein. Lithiumhydroxid ist beispielsweise a starke Basis weil es in wässriger Lösung vollständig zu Hydroxidionen OH und Lithium Li-Kationen ionisiert+:
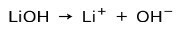
Auf der anderen Seite Ammoniak NH3 ist ein schwache Basis Denn bei Kontakt mit Wasser dissoziiert nicht alles Ammoniak:
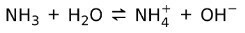
Sachstand der Basen
Basen kommen in festem, flüssigem und gasförmigem Zustand vor. Zum Beispiel ist reines Natriumhydroxid fest, Ammoniak ist ein Gas.
Reaktion mit dem Lackmuspapier der Basen
Wenn wir einen Streifen Lackmuspapier in eine alkalische Substanz legen, wird das Papier blau.
Identifizierung von Basen durch ihren pH
Die Basen zeichnen sich durch einen pH-Wert zwischen 7 und 14 aus.
 Elektrische Leitfähigkeit der Basen
Elektrische Leitfähigkeit der Basen
Die Basen sind aufgrund ihrer Ionisationskapazität gute Stromleiter. In Alkalibatterien wird beispielsweise Kaliumhydroxid KOH als elektrischer Leiter verwendet.
Korrosive Wirkung von Basen
Starke Basen können organisches Gewebe schädigen. Küchenofenreiniger zum Beispiel sind im Allgemeinen starke Basen, und es wird immer empfohlen, sie mit äußerster Vorsicht zu handhaben, Handschuhe und Augenschutz zu tragen.
Schwache Basen bilden ein konjugiertes Gegenstück
Die schwachen Basen bilden beim Auflösen ein konjugiertes Gegenstück, dh eine schwache Base bildet eine konjugierte Säure.
Zum Beispiel Tris-(hydroxymethyl)aminomethan (OHCH2)3CNH2 ist eine schwache Base, deren konjugierte Säure (OHCH2)3CNH3+:
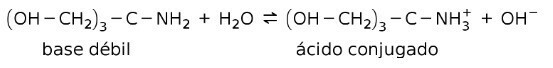
Dies ist die Wirkungsgrundlage der Puffersubstanzen bzw Puffer, das sind Substanzen, die verwendet werden, um den pH-Wert von Lösungen konstant zu halten.
Vielleicht interessieren Sie sich für die Unterschiede zwischen:
- Säuren und Basen.
- Kationen und Anionen



