ΟΡΙΣΜΟΣ θετικών ή αρνητικών IONS

Όπως ήδη γνωρίζουμε, άτομα σχηματίζονται από υποατομικά σωματίδια. Από τους τρεις τύπους υποατομικών σωματιδίων, μόνο τα νετρόνια δεν έχουν ηλεκτρικό φορτίο. Αντ 'αυτού, τα πρωτόνια έχουν θετικό ηλεκτρικό φορτίο ενώ τα ηλεκτρόνια έχουν αρνητικό φορτίο. Μόνο τα ηλεκτρόνια, που καταλαμβάνουν την περιφέρεια του ατόμου, μπορούν να μεταφερθούν από το ένα άτομο στο άλλο, ενώ τα πρωτόνια στον πυρήνα διατηρούν τον αριθμό τους σταθερό. Σε αυτό το μάθημα από έναν εκπαιδευτή θα δούμε τι συμβαίνει όταν άτομα ή μόρια κερδίζουν ή χάνουν ηλεκτρόνια. Δηλαδή, θα δούμε τον ορισμό και τα παραδείγματα θετικών ή αρνητικών ιόντων.
Δείκτης
- Τι είναι τα ιόντα; Εύκολος ορισμός
- Σχηματισμός ιόντων: ηλεκτροσυγγένεια και ηλεκτροαρνητικότητα
- Τι είναι τα αρνητικά ιόντα; Με παραδείγματα
- Τι είναι τα θετικά ιόντα; Με παραδείγματα
Τι είναι τα ιόντα; Εύκολος ορισμός.
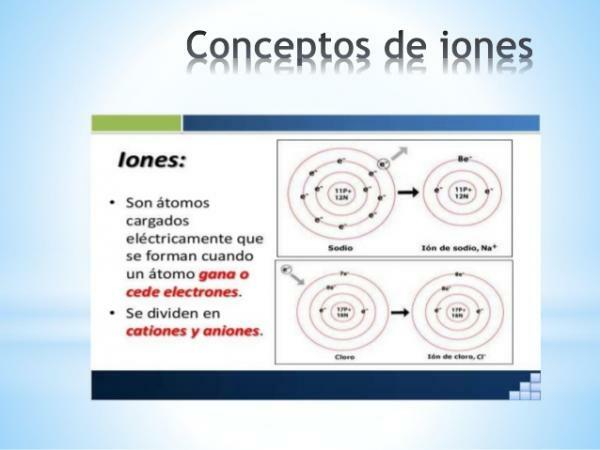
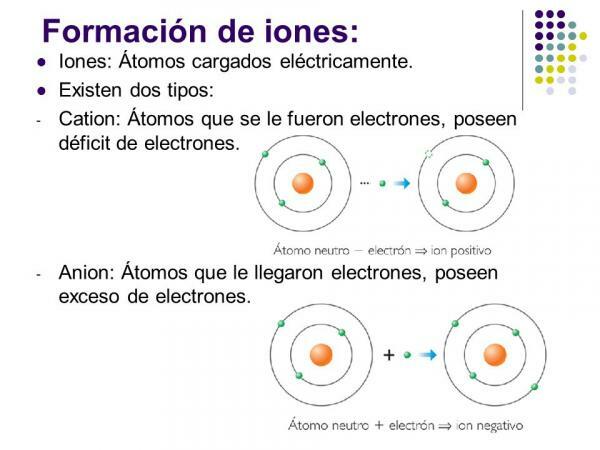
ΕΝΑ ιόν είναι οποιοδήποτε άτομο ή μόριο με καθαρό ηλεκτρικό φορτίο. Δηλαδή, είναι ένα άτομο ή ένα σύνολο ατόμων που συνδέονται μεταξύ τους, των οποίων τα ηλεκτρικά φορτία
δεν αποζημιώνονται. Αυτή η αποζημίωση των φορτίων συμβαίνει όταν ένα ή περισσότερα ηλεκτρόνια ενώνονται ή αφήνουν ένα άτομο ή ένα σύνολο ατόμων.Τα ιόντα είναι έτσι φορτισμένα άτομα ή μόρια, λόγω του κέρδους ή της απώλειας ηλεκτρονίων (υποατομικά σωματίδια με αρνητικό φορτίο και αμελητέα μάζα).
Τύποι ιόντων: monatomic και polyatomic
Εάν λάβουμε υπόψη τη σύνθεση των ιόντων, διακρίνονται δύο τύποι: τα μονοτομικά ιόντα και τα πολυατομικά ιόντα.
- Όπως υποδηλώνει το όνομα, μονοτομικά ιόντα αυτά που σχηματίζονται από ένα ένα άτομο.
- Ιονικές ενώσεις o πολυατομικά ιόντα είναι εκείνα στα οποία τα άτομα συνδέονται ομοιοπολικά (μοιράζονται ένα ή περισσότερα ζεύγη ηλεκτρονίων στον δεσμό) παρουσιάζοντας έναν αριθμό νετρόνια στο μόριο διαφορετικό από τον συνολικό αριθμό ηλεκτρονίων.
- ο πολυατομικά ιόντα συνήθως περιέχουν οξυγόνο και συνήθως έχουν μια δομή με ένα κεντρικό άτομο γύρω από το οποίο διατάσσονται τα υπόλοιπα στοιχεία που απαρτίζουν το μόριο.
- ο φορτίο των μονοτομικών ιόντων των αντιπροσωπευτικών στοιχείων (οικογένειες 1 και 2 του πίνακα και οικογένειες 13 έως 17 του περιοδικού πίνακα) μπορούν εύκολα να εξαχθούν εάν είναι γνωστή η θέση τους εντός του περιοδικού πίνακα. Σε αυτές τις περιπτώσεις τα άτομα κερδίζουν ή χάνουν ηλεκτρόνια για να φθάσουν, στο κέλυφος σθένους τους, τη διαμόρφωση του ευγενούς αερίου της περιόδου του (μικρό2Π6), ή το ίδιο, εκπληρώστε το κανόνας οκτάδας.
Εικόνα: Slideshare
Σχηματισμός ιόντων: ηλεκτροσυγγένεια και ηλεκτροαρνητικότητα.
Η ικανότητα των ατόμων ή των μορίων να σχηματίζουν ιόντα καθορίζεται από δύο περιοδικές ιδιότητες: ηλεκτροσυγγένεια και ηλεκτροαρνητικότητα. Και οι δύο ιδιότητες αυξάνουν την αξία σε μια περίοδο και μειώνονται καθώς κατεβαίνουμε μέσω μιας ομάδας ή οικογένειας του περιοδικού πίνακα.
ο ηλεκτρο συγγένεια, που ονομάζεται επίσης συγγένεια ηλεκτρονίων, είναι μια ατομική ιδιότητα που ορίζεται ως η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια. Στην περίπτωση των ενώσεων, μια παρόμοια ιδιότητα ονομάζεται ηλεκτροαρνητικότητα η οποία ορίζεται ως η ικανότητα ενός ατόμου να προσελκύει ηλεκτρόνια όταν σχηματίζει δεσμό με άλλο άτομο. Και οι δύο ιδιότητες ορίζουν έτσι την τάση ενός στοιχείου να συλλάβει ή να χάνει ηλεκτρόνια.
Ιωνικοί δεσμοί
Στη στερεή τους μορφή, τα ιόντα σχηματίζουν ενώσεις ή ιοντικοί κρύσταλλοι (άλατα), που σχηματίζεται από τον συνδυασμό ιόντων διαφορετικών σημείων που ενώνονται μέσω του ιοντικοί δεσμοί. Το πιο γνωστό παράδειγμα αυτού του τύπου ένωσης είναι το κοινό άλας (χλωριούχο νάτριο: NaCl).
Ο ιονικός δεσμός αποτελείται από ενώσεις ιόντων διαφορετικού σημείου μέσω ηλεκτροστατικών ελκυστικών δυνάμεων (έλξη μεταξύ φορτίων αντίθετου σημείου). Στοιχεία των οποίων η ηλεκτροαρνητικότητα ή η ηλεκτροσυγγένεια είναι πολύ διαφορετική (μεταλλικά και μη μεταλλικά στοιχεία) παρεμβαίνουν σε αυτόν τον τύπο συνδέσμων. Στις περισσότερες περιπτώσεις, αυτές οι ιοντικές ενώσεις είναι διαλυτό στο νερό και άλλους πολικούς διαλύτες.
Σε υδατικά διαλύματα, οι ιονικές ενώσεις διαχωρίζονται σε ελεύθερα ιόντα, τα οποία ονομάζονται ηλεκτρολύτες, καθώς η παρουσία του στο διάλυμα κάνει το νερό να συμπεριφέρεται ως ηλεκτρικός αγωγός.
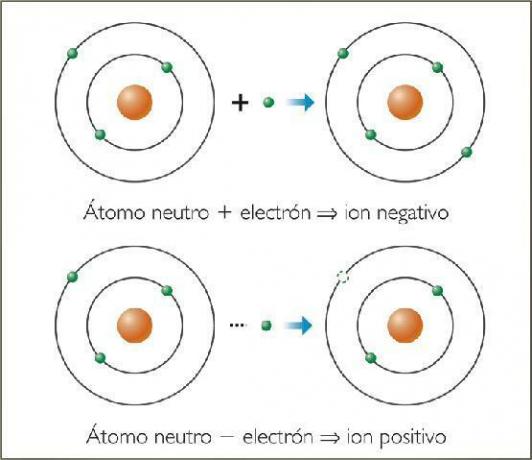
Τι είναι τα αρνητικά ιόντα; Με παραδείγματα.
ο αρνητικά ιόντα Καλούνται ανιόντα. Σε όλες τις περιπτώσεις, είναι άτομα μη μεταλλικών στοιχείων ή μορίων που περιέχουν μη μεταλλικά στοιχεία. Αυτά τα στοιχεία χαρακτηρίζονται από το ότι έχουν πολύ υψηλή συγγένεια και ηλεκτροαρνητικότητα. Δηλαδή, είναι ιόντα που σχηματίζονται από στοιχεία με υψηλή τάση σύλληψης ηλεκτρονίων.
Μονοτομικά ανιόντα: ορισμός και παραδείγματα
Είναι τα ανιόντα που σχηματίζονται από άτομα μη μεταλλικών στοιχείων (ομάδες 13 έως 17 του περιοδικού πίνακα), τα οποία έχουν αποκτήσει ένα ή περισσότερα ηλεκτρόνια. Αυτά τα ανιόντα έχουν από κοινού την ηλεκτρονική δομή ευγενών αερίων2Π6) στο εξωτερικό του περίβλημα ηλεκτρονίων (κέλυφος σθένους).
Παραδείγματα:
- Ιόν χλωριδίου: Cl-
- Ιόν φθορίου: F-
- Ιόν ιωδίου: I-
- Ιόντα σουλφιδίου: S-2
- Ιόν νιτριδίου: Ν-3
Πολυτομικά ανιόντα: ορισμός και παραδείγματα
Είναι αρνητικά φορτισμένα ιόντα που σχηματίζονται από δύο ή περισσότερα άτομα μη μεταλλικών στοιχείων που συνδέονται με ομοιοπολικούς δεσμούς. Είναι τα πιο συνηθισμένα πολυατομικά ιόντα. Τα πιο συνηθισμένα πολυατομικά ανιόντα είναι τα οξοανιόνια, τα οποία αποτελούνται από ένα κεντρικό μη μεταλλικό άτομο και περιέχουν οξυγόνο.
Γενικά, θεωρούνται χημικές ενώσεις που λαμβάνονται όταν μια όξινη ένωση χάνει ένα ή περισσότερα πρωτόνια (Η+). Αυτά τα πολυατομικά ανιόντα μπορούν να διατηρήσουν λίγο υδρογόνο στη δομή τους, γεγονός που τους δίνει έναν ορισμένο οξύ χαρακτήρα (ικανότητα να εγκαταλείψουν τα πρωτόνια).
Παραδείγματα:
- Νιτρικό άλας: ΝΟ3-
- Υπερμαγγανικό ιόν: MnO4-
- Φωσφορικό ιόν: PO4-3
- Όξινο ανθρακικό ή διττανθρακικό ιόν: HCO3-
- Ιόντα θειώδους: SO3-2
Εικόνα: Naturopathy
Τι είναι τα θετικά ιόντα; Με παραδείγματα.
Τα θετικά ιόντα ονομάζονται ντοιόντα. Σε όλες σχεδόν τις περιπτώσεις, είναι άτομα μεταλλικών στοιχείων ή μορίων που περιέχουν μεταλλικά στοιχεία. Αυτά τα στοιχεία χαρακτηρίζονται από το ότι έχουν πολύ χαμηλή ηλεκτρική συγγένεια και ηλεκτροαναγονικότητα, γι 'αυτό δείχνουν σαφή τάση να χάνουν ηλεκτρόνια.
Μονοτομικά κατιόντα: ορισμός και παραδείγματα
Είναι ιόντα με θετικό φορτίο (λόγω της απώλειας ηλεκτρονίων) που σχηματίζονται από ένα μόνο άτομο μεταλλικού στοιχείου. Σε αυτήν την περίπτωση, το κατιόν σχηματίζεται από την απώλεια ηλεκτρονίων που επιτρέπουν στο στοιχείο να αδειάσει την εξώτατη ηλεκτρονική του στρώση και να αποκτήσει μια ευγενή διαμόρφωση αερίου2Π6) από το χαμηλότερο επίπεδο. Είναι ο πιο κοινός τύπος κατιόντος.
Παραδείγματα:
- Υδρογόνο ή κατιόν υδρογόνου (ονομάζεται επίσης πρωτόνιο): H+
- Κατιόν νατρίου: Na+
- Κατιόν σιδήρου (III) ή κατιόν σιδήρου: Fe+3
- Κατιόν ασβεστίου: Ca+2
- Χαλκός (II) ή κατιόν χαλκού: Cu+2
Πολυτομικά κατιόντα: ορισμός και παραδείγματα
Τα πολυατομικά κατιόντα είναι εκείνα που σχηματίζονται από δύο ή περισσότερα άτομα. Είναι σπάνια, τα πιο άφθονα είναι τα λεγόμενα ομοπολιτικά πυρηνικά κατιόντα που περιέχουν περισσότερα από ένα άτομο του ίδιου στοιχείου, στην περίπτωση του ιόντος τριυδρογόνου, είναι ένα από τα πιο άφθονα μόρια σύμπαν. Τα πολυατομικά κατιόντα που σχηματίζονται από άτομα διαφορετικών στοιχείων δεν είναι κοινά, αλλά χαρακτηρίζονται από η παρουσία υδρογόνου και θεωρείται ότι προέρχεται όταν μια βασική ένωση συλλαμβάνει ένα πρωτόνιο (Η+).
Παραδείγματα:
- Κατιόν αμμωνίου: NH4+
- Κατιόν οξονίου: HO3+
- Κατιόν φωσφονίου: PH3+
- Τριυδρογόνο κατιόν ή πρωτονιωμένο μοριακό υδρογόνο: H3+
- Κατιόν Dimercury: Hg2+2
Εικόνα: Πλανήτες
Αν θέλετε να διαβάσετε περισσότερα άρθρα παρόμοια με Αρνητικά και θετικά ιόντα: ορισμός και παραδείγματα, σας συνιστούμε να εισαγάγετε την κατηγορία μας Το άτομο.
Βιβλιογραφία
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Βασική χημεία. Μαδρίτη: Uned