Ανακαλύψτε πώς οργανώνεται ο ΠΕΡΙΟΔΙΚΟΣ ΠΙΝΑΚΑΣ με ΕΥΚΟΛΟ και ΠΡΑΚΤΙΚΟ τρόπο

Εικόνα: ptable.com
Το 1869, ο Ρώσος χημικός Dimitri Ivanovich Mendeleev επινόησε έναν τρόπο ταξινομούν όλα τα χημικά στοιχεία που εμφανίζονται στη φύση. Αυτή η μέθοδος ταξινόμησης είναι ο περιοδικός πίνακας και πολλοί την περιγράφουν ως την «καρδιά της χημείας». Ο περιοδικός πίνακας γεννήθηκε με μόνο 63 χημικά στοιχεία, αλλά, όπως ανακαλύφθηκαν, πολλά χημικά στοιχεία προστέθηκαν στις σειρές του.
Σε αυτό το μάθημα από έναν εκπαιδευτή θα επανεξετάσουμε πώς οργανώνεται ο περιοδικός πίνακας, βλέποντας ποια κριτήρια ακολουθούνται όταν τοποθετείτε τα διαφορετικά στοιχεία στα πλαίσια αυτού του πίνακα.
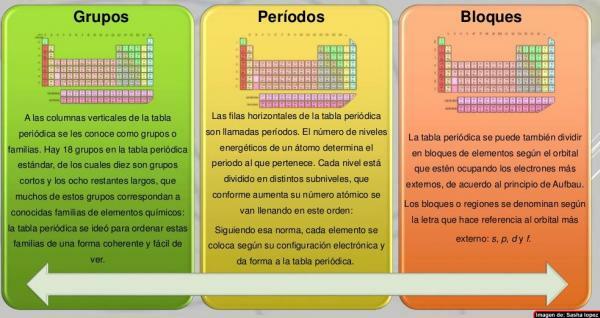
Στο στήλες του περιοδικού πίνακα έχουν ονομαστεί ομάδες. Επί του παρόντος, στον περιοδικό πίνακα που χρησιμοποιείται συνήθως, δηλαδή στον τυπικό, υπάρχουν 18 ομάδες, αριθμημένες από αριστερά προς τα δεξιά από 1 έως 18. Αυτός ο τρόπος ονομασίας οι ομάδες (ονοματολογία) μπορεί να διαφέρει: μερικές φορές χρησιμοποιείται μια μικτή ονοματολογία ρωμαϊκών αριθμών και γραμμάτων, σε άλλες περιπτώσεις οι ομάδες έχουν κοινά ονόματα (μέταλλα αλκάλια, αλογόνα, ευγενή αέρια, κ.λπ.) και σε άλλα ονομάζονται ως "η ομάδα του ..." και το όνομα του πρώτου μέλους του (για παράδειγμα, "η ομάδα του σκανδίου" για την ομάδα 3).
Στοιχεία της ίδιας ομάδας μπορούν να έχουν μοτίβα διαφορετικών ιδιοτήτων:
- Αύξηση της ατομικής ακτίνας, από πάνω προς τα κάτω σε μια ομάδα. Καθώς κατεβαίνουμε στον περιοδικό πίνακα, ο αριθμός των ηλεκτρονίων αυξάνεται και συνεπώς ο αριθμός των κελυφών που γεμίζουν μαζί τους. Επομένως, τα ηλεκτρόνια στο τελευταίο κέλυφος (κέλυφος σθένους) βρίσκονται πιο μακριά από τον πυρήνα και τα άτομα γίνονται όλο και μεγαλύτερα, δηλαδή έχουν μεγαλύτερη ακτίνα.
- Από την κορυφή, κάθε στοιχείο έχει ένα χαμηλότερη ενέργεια ιονισμού. Καθώς υπάρχουν περισσότερα ηλεκτρόνια, αυτά που βρίσκονται στο κέλυφος σθένους είναι μακρύτερα από τον πυρήνα και συνεπώς Αυτό τους προσελκύει με λιγότερη δύναμη, καθιστώντας ευκολότερη την αφαίρεση ηλεκτρονίων καθώς κατεβαίνουμε στο τραπέζι. περιοδικός.
- Τέλος, παρατηρούμε επίσης ένα μείωση της ηλεκτροπαραγωγικότητας εντός της ίδιας ομάδας. Και πάλι, καθώς η απόσταση μεταξύ των ηλεκτρονίων σθένους και του πυρήνα αυξάνεται, τα ηλεκτρόνια άλλων ατόμων είναι πιο μακριά από την ελκυστική δύναμη του πυρήνα και ως εκ τούτου τους προσελκύει λιγότερο έντονα από τα μικρότερα άτομα (ομάδες πιο ψηλά).
Αυτές οι κανονικότητες είναι τάσεις, δηλαδή, υπάρχουν ορισμένες εξαιρέσεις, όπως αυτό που συμβαίνει στην ομάδα 11, όπου η ηλεκτροπαραγωγικότητα αυξάνεται περαιτέρω κάτω από την ομάδα. Επίσης, σε ορισμένα μέρη του περιοδικού πίνακα, όπως τα μπλοκ d και f, οι οριζόντιες ομοιότητες μεταξύ στοιχείων της ίδιας ομάδας δεν είναι τόσο σημαντικές.

Εικόνα: Ερευνητική βιβλιοθήκη
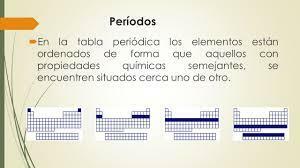
Οι επτά οριζόντιες σειρές του περιοδικού πίνακα καλούνται έμμηνα. Ο αριθμός των ενεργειακών επιπέδων ενός ατόμου καθορίζει την περίοδο στην οποία ανήκει. Κάθε επίπεδο χωρίζεται σε διαφορετικές κατηγορίες που ονομάζονται κελύφη ή ηλεκτρονικά τροχιακά που μπορούν να είναι τύπου s, p, d και f.
Όπως συνέβη στις ομάδες, στοιχεία από την ίδια περίοδο έχουν παρόμοια μοτίβα ατομική ακτίνα, ενέργεια ιονισμού, συγγένεια ηλεκτρονίων και ηλεκτροαρνητικότητα:
- Σε μια περίοδο, την ατομική ακτίνα κανονικά κατεβαίνει αν μετακινηθούμε προς τα δεξιά στον περιοδικό πίνακα. Καθώς προχωρούμε από το ένα στοιχείο στο άλλο, προστίθενται πρωτόνια και ηλεκτρόνια, προκαλώντας τα στοιχεία ηλεκτρόνια έλκονται στον πυρήνα (θυμηθείτε ότι τα ηλεκτρόνια είναι πολύ ελαφριά για την ελκυστική δύναμη πυρήνας).
- Η μείωση της ατομικής ακτίνας την ίδια περίοδο κάνει το ενέργεια ιονισμού και ηλεκτροπαραγωγικότητα αυξάνεται από αριστερά προς τα δεξιά, καθώς η έλξη που ασκεί ο πυρήνας στα ηλεκτρόνια αυξάνεται.
- ο Ηλεκτρονική συγγένεια δείχνει επίσης ένα μοτίβο κατά τη διάρκεια της περιόδου, αν και ηπιότερη. Τα μέταλλα, που βρίσκονται στα αριστερά του περιοδικού πίνακα, έχουν γενικά χαμηλότερη συγγένεια από τα μη μέταλλα, τα οποία βρίσκονται στα δεξιά της περιόδου. Αυτό είναι γενικότητα και δεν ισχύει για τα ευγενή αέρια, τα οποία έχουν γεμίσει το τελευταίο τους στρώμα (στρώμα σθένους) και επομένως είναι ελάχιστα αντιδραστικά.
Εικόνα: SlidePlayer
Τα στοιχεία του περιοδικού πίνακα μπορούν να χωριστούν σε μπλοκ σύμφωνα με τη σειρά με την οποία ολοκληρώνονται τα κελύφη ηλεκτρονίων των στοιχείων. Κάθε μπλοκ ονομάζεται σύμφωνα με το αργότεροτροχιακή στην οποία, θεωρητικά, είναι το τελευταίο ηλεκτρόνιο (s, p, d ή f):
- Το μπλοκ s Αποτελείται από τις δύο πρώτες ομάδες, το υδρογόνο και το ήλιο.
- Το μπλοκ p Αποτελείται από τις τελευταίες έξι ομάδες (ομάδες 13 έως 18).
- Μπλοκ d Σχηματίζονται οι ομάδες 3 έως 12 (συνήθως αποκαλούνται μεταβατικά μέταλλα).
- Το μπλοκ f, το οποίο συνήθως τοποθετείται χωριστά, κάτω από το υπόλοιπο του περιοδικού πίνακα, δεν έχει αριθμούς ομάδων και αποτελείται από λανθανίδες και ακτινίδες.
Ο περιοδικός πίνακας των στοιχείων έχει επιβιώσει για τόσα χρόνια επειδή είναι ένα σύστημα που έχει αποδειχθεί πολύ χρήσιμο και πάνω απ 'όλα επειδή μπορεί να ενημερωθεί. Θεωρητικά, θα μπορούσαν να υπάρχουν περισσότερα στοιχεία που θα γεμίζουν άλλα τροχιακά, αλλά αυτά δεν έχουν ακόμη συντεθεί ή δεν έχουν ανακαλυφθεί. Σε περίπτωση που ανακαλύφθηκαν νέα ατομικά στοιχεία, οι ερευνητές θα συνέχιζαν με την αλφαβητική σειρά να ονομάσουν τα διαφορετικά μπλοκ (μπλοκ g, μπλοκ h, κ.λπ.).
Εικόνα: Educando, η πύλη της Δομινικανής Εκπαίδευσης