Διαφορά μεταξύ ισχυρών και ασθενών οξέων και βάσεων (με παραδείγματα)
Η ταξινόμηση των οξέων και των βάσεων στη χημεία εξαρτάται από τη δύναμη ιονισμού αυτών των ουσιών σε υδατικό μέσο. Α) Ναι:
- ένα οξύ και μια βάση είναι ισχυρά όταν ιονίζονται πλήρως, δηλαδή, στη διαδικασία ιονισμού μετατρέπονται πλήρως σε κατιόντα ή θετικά ιόντα και σε ανιόντα ή αρνητικά ιόντα.
- Αφ 'ετέρου, ένα οξύ και μια βάση είναι αδύναμα όταν ιονίζονται μερικώς σε νερό, δηλαδή σε διάλυμα θα υπάρχει αναλογία κατιόντων, άλλη αναλογία ανιόντων και άλλη αναλογία μη διαχωρισμένων μορίων.
| Ισχυρά οξέα και βάσεις | Αδύναμα οξέα και βάσεις | |
|---|---|---|
| Ορισμός | Ουσίες που ιονίζονται πλήρως σε διάλυμα. | Ουσίες που ιονίζονται μερικώς σε διάλυμα. |
| Ιονισμός | Πλήρης | Μερικός |
| Στοιχεία σε υδατικό διάλυμα | Κατιόντα και ανιόντα στην ίδια συγκέντρωση. | Κατιόντα, ανιόντα και μόρια σε διαφορετικές αναλογίες. |
| Σταθερή ιονισμού | Ανυψωμένο | Λίγο |
| Παραδείγματα |
|
|
Ισχυρά οξέα και βάσεις
ΕΝΑ το οξύ ή μια βάση είναι ισχυρά όταν σε ένα υδατικό μέσο διαχωρίζονται πλήρωςΜε άλλα λόγια, η διαδικασία ιονισμού είναι πλήρης και το διάλυμα θα περιέχει την ίδια συγκέντρωση ανιόντων και κατιόντων.
Πώς ιοντίζετε ένα οξύ και μια ισχυρή βάση;
Ένα ισχυρό οξύ, όπως το υδροχλωρικό οξύ HCl, ιονίζεται με τον ακόλουθο τρόπο:
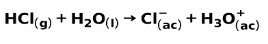
Μια ισχυρή βάση, όπως το υδροξείδιο του νατρίου NaOH, ιονίζεται με τους ακόλουθους τρόπους:
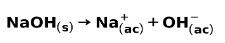
Παραδείγματα ισχυρών οξέων και των τύπων τους
| Ισχυρά οξέα | Τύπος |
|---|---|
| Υδροχλωρικό οξύ | ΗΟΙ |
| Θειικό οξύ | Η2ΝΔ4 |
| Νιτρικό οξύ | HNO3 |
| Υδροβρωμικό οξύ | HBr |
| Υπερχλωρικό οξύ | HClO4 |
| Χρωμικό οξύ | Η2Κρο4 |
| Τετραφλουροβορικό οξύ | HBF4 |
Παραδείγματα ισχυρών βάσεων και των τύπων τους
| Ισχυρή βάση | Τύπος |
|---|---|
| Υδροξείδιο του νατρίου | ΝαΟΗ |
| Υδροξείδιο λιθίου | ΛΙΟΗ |
| Υδροξείδιο του καλίου | ΚΟΗ |
| Υδροξείδιο του ρουβιδίου | RbOH |
| Υδροξείδιο του καισίου | CsOH |
| Υδροξείδιο του ασβεστίου | Ca (ΟΗ)2 |
| Υδροξείδιο του βαρίου | Μπα (ΟΗ)2 |
| Υδροξείδιο του στροντίου | Sr (ΟΗ)2 |
| Υδροξείδιο αργιλίου | Αλ (ΟΗ)3 |
Μπορεί να σας ενδιαφέρει να δείτε περισσότερα παραδείγματα οξέων και βάσεων.
Αδύναμα οξέα και βάσεις
ΕΝΑ Το οξύ ή η βάση είναι αδύναμα όταν ιονίζονται μερικώς σε υδατικό διάλυμα, δηλαδή, στο διάλυμα υπάρχουν ιόντα και μη ιονισμένα μόρια.
Πώς ιοντίζετε ένα οξύ και μια αδύναμη βάση;
Ένα ασθενές οξύ, όπως το οξικό οξύ CH3Το COOH, ιονίζεται με τον ακόλουθο τρόπο:
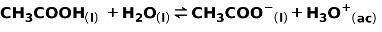
Η ισορροπία αυτής της αντίδρασης εκφράζεται από τα δύο βέλη σε αντίθετες κατευθύνσεις.
Όταν ένα ασθενές οξύ διαχωρίζεται ή ιονίζεται, δημιουργείται ισορροπία μεταξύ των ειδών που υπάρχουν στο διάλυμα. αυτό μπορεί να εκφραστεί με ένα σταθερά ιονισμούθυμώνω:
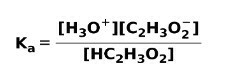
Η σταθερά ιονισμού δεν είναι τίποτα περισσότερο από την αναλογία μεταξύ του πολλαπλασιασμού της συγκέντρωσης των προϊόντων έναντι του πολλαπλασιασμού της συγκέντρωσης των αντιδρώντων.
Μια αδύναμη βάση, όπως η αμμωνία NH3, ιονίζεται με τον ακόλουθο τρόπο:
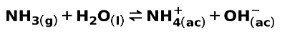
Όταν μια ασθενής βάση διαχωρίζεται ή ιονίζεται, δημιουργείται ισορροπία μεταξύ των ειδών που υπάρχουν στο διάλυμα. αυτό μπορεί να εκφραστεί με ένα σταθερά ιονισμού βάσης:
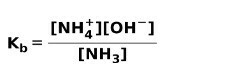
Μπορεί να σας ενδιαφέρει να μάθετε τη διαφορά μεταξύ Οξέα και βάσεις.
Παραδείγματα ασθενών οξέων με τον τύπο τους και τη σταθερά ιονισμού οξέος Κπρος την
| Αδύναμο οξύ | Τύπος | Σταθερή ιονισμού |
|---|---|---|
| Φορμικό οξύ | Η2CO2 | 1,77 χ 10-4 |
| Οξικό οξύ | Η3CCOH | 1,75 x 10-5 |
| Υδροκυανικό οξύ | HOCN | 3,30 χ 10-4 |
| Υδροκυάνιο | HCN | 6,20 χ 10-10 |
| Υποχλωρικό οξύ | HOCl | 3,50 χ 10-8 |
| Νιτρώδες οξύ | HNO2 | 4,00 x 10-4 |
| Γαλακτικό οξύ | HC3Η5Ή3 | 1,40 x 10-4 |
| Ανθρακικό οξύ | Η2CO3 |
4,30 χ 10-7 5,60 χ 10-11 |
| Βορικό οξύ | Η3BO3 |
5,80 χ 10-10 1,80 x 10-13 3,00 χ 10-14 |
Παραδείγματα ασθενών βάσεων με τον τύπο τους και τη βασική σταθερά ιονισμού Κσι
| Αδύναμη βάση | Τύπος | Σταθερή ιονισμού |
|---|---|---|
| Αμμωνία | ΝΗ3 | 1,75 x 10-5 |
| Μεθυλαμίνη | Χ.Χ.3ΝΗ2 | 4,38 χ 10-4 |
| Αιθυλαμίνη | ντο2Η5ΝΗ2 | 5,60 χ 10-4 |
| Ανιλίνη | ντο6Η5ΝΗ2 | 3,80 χ 10-10 |
| Πυριδίνη | ντο5Η5Ν | 1,70 x 10-9 |
| Βενζυλαμίνη | ντο7Η9Ν | 2,20 x 10-5 |
| Διττανθρακικό νάτριο | NaHCO | 2,00 x 10-4 |
Μπορεί να σας ενδιαφέρει να μάθετε περισσότερα Χαρακτηριστικά οξέων και βάσεων