Χαρακτηριστικά οξέων και βάσεων: κύριες διαφορές
Τα χαρακτηριστικά των οξέων και των βάσεων είναι όλες αυτές οι ιδιότητες και ιδιότητες με τις οποίες μπορούμε να διακρίνουμε μεταξύ ενός οξέος και μιας βάσης.
Σύμφωνα με τη θεωρία του Arrehnius, α οξύ είναι μια ουσία που απελευθερώνει πρωτόνια Η+ όταν διαλύεται σε νερό και a βάση είναι οποιαδήποτε ουσία που απελευθερώνει υδροξυλικά ιόντα ΟΗ- όταν σε υδατικό διάλυμα.
| Οξέα | Βάσεις | |
|---|---|---|
| Σχηματισμός ιόντων | Παρόν | Παρόν |
| Αντίδραση εξουδετέρωσης | Όταν αντιδρά με βάση. | Όταν αντιδρά με ένα οξύ. |
| Διαλυτότητα του νερού | Διαλυτός | Μερικώς διαλυτό. Τα υδροξείδια ασβεστίου, βαρίου και αργιλίου είναι ελάχιστα διαλυτά. |
| Ηλεκτρική αγωγιμότητα | Παρόν | Παρόν |
| Κατάσταση της ύλης | Στερεό, υγρό ή αέριο | Στερεό, υγρό ή αέριο |
| Αντίδραση με χαρτί litmus | Κόκκινο χρώμα | Μπλε χρωματισμός |
| Τιμή PH | Κάτω των 7 ετών | Μεγαλύτερο από 7 |
| Συζευγμένο ομόλογο | Ένα ασθενές οξύ σχηματίζει μια συζυγή βάση. | Μια ασθενής βάση σχηματίζει ένα συζευγμένο οξύ. |
| Διαβρωτικό αποτέλεσμα | Ισχυρά οξέα | Ισχυρές βάσεις |
Χαρακτηριστικά οξέων
Τα οξέα έχουν πολλά χαρακτηριστικά με τα οποία μπορούν να ταυτοποιηθούν.
Ικανότητα σχηματισμού ιόντων από οξέα
Το κύριο χαρακτηριστικό των όξινων ουσιών είναι ότι μπορούν να ιονιστούν, δηλαδή να χάσουν ή να αποκτήσουν ηλεκτρόνια.
Το υδροχλωρικό οξύ HCl, ένα ισχυρό οξύ, ιονίζεται για να σχηματίσει χλωριούχο ανιόν Cl- και πρωτόνιο Η+.
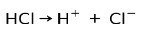
Αντίδραση εξουδετέρωσης
Ένα οξύ αντιδρά με μια βάση για να σχηματίσει ένα αλάτι και νερό. Αυτή η αντίδραση είναι γνωστή ως αντίδραση εξουδετέρωσης. Για παράδειγμα, το HCl αντιδρά με NaOH για να σχηματίσει NaCl χλωριούχου νατρίου (αλάτι κουζίνας) και νερό:
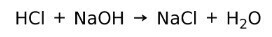
Υδατοδιαλυτότητα των οξέων
Τα οξέα είναι γενικά διαλυτά στο νερό. Για παράδειγμα, το υδροχλωρικό οξύ ή το muriatic οξύ είναι μέτρια διαλυτό στο νερό, έως 82 g HCl μπορούν να διαλυθούν σε 100 ml νερού στους 0 ° C. Στην περίπτωση του θειικού οξέος Η2ΝΔ4, το μείγμα με νερό δημιουργεί θερμότητα, επομένως συνιστάται πάντα η προσθήκη οξέος στο νερό για την αποφυγή εκρήξεων.
Αντοχή σε οξύ
Ο τρόπος διάσπασης των οξέων καθορίζει εάν είναι ισχυρά ή αδύναμα. Η ισχύς ενός οξέος δίνεται από αυτό σταθερά διαχωρισμού.
Νιτρικό οξύ HNO3 είναι ένα ισχυρό οξύ επειδή σε υδατικό διάλυμα ιονίζεται πλήρως σε πρωτόνια και νιτρικά ιόντα:

Αυτό σημαίνει ότι όταν προσθέτουμε HNO3 στο νερό, όταν αναλύουμε το νερό θα βρούμε μόνο H+ και νιτρικά ιόντα, και ουσιαστικά κανένα HNO3.
Αντ 'αυτού, το οξικό οξύ που βρίσκεται στο ξύδι είναι ένα ασθενές οξύ, επειδή μόνο ένα μέρος του είναι αποσυνδεδεμένο:
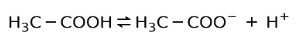
Γι 'αυτό παριστάνεται με βέλη προς δύο κατευθύνσεις, αυτό σημαίνει ότι σε υδατικό διάλυμα θα έχουμε οξικό οξύ, H+ και το οξικό ανιόν (Η3Γ-COO-).
Καταστάσεις ύλης οξέων
Τα οξέα μπορούν να βρεθούν σε υγρή, στερεά ή αέρια κατάσταση. Για παράδειγμα, το υδροχλωρικό οξύ HCl είναι υγρό, το υδρόθειο HS είναι αέριο και το οξαλικό οξύ είναι στερεό.
Αντίδραση με χαρτί λίτρων από οξέα

Όταν τοποθετούμε μια λωρίδα χαρτιού litmus σε μια όξινη ουσία, το χαρτί litmus γίνεται κόκκινο.
Ταυτοποίηση των οξέων από το pH τους
Το PH είναι το μέτρο της ποσότητας H+ παρόν σε μια λύση. Έτσι, μεταξύ pH 0 και 7, είμαστε παρουσία ενός οξέος. Για παράδειγμα, το ξίδι έχει pH ίσο με 2, το pH θειικού οξέος στις μπαταρίες αυτοκινήτου είναι ίσο με 1.
Ηλεκτρική αγωγιμότητα οξέων
Δεδομένου ότι τα οξέα μπορούν να διαχωρίσουν και να παράγουν ηλεκτρικά φορτισμένα ιόντα, τα όξινα διαλύματα μπορούν να μεταφέρουν ηλεκτρισμό. Για παράδειγμα, στις μπαταρίες του αυτοκινήτου, το θειικό οξύ, το οποίο είναι ισχυρό οξύ, χρησιμοποιείται ως αγωγός ηλεκτρικής ενέργειας.
Διαβρωτική επίδραση ισχυρών οξέων
Τα ισχυρά οξέα έχουν διαβρωτική δράση, μπορούν να κάψουν οργανικούς ιστούς, οπότε ο χειρισμός τους πρέπει να είναι εξαιρετικά προσεκτικός.
Τα αδύναμα οξέα σχηματίζουν ένα συζευγμένο αντίστοιχο
Όταν διαλύονται, τα ασθενή οξέα σχηματίζουν αυτό που είναι γνωστό ως ζεύγος συζευγμάτων, δηλαδή, ένα ασθενές οξύ σχηματίζει μια βάση συζεύγματος.
Για παράδειγμα:

Σε αυτήν την περίπτωση, μυρμηκικό ή μεθανοϊκό οξύ (HCOOH), όταν διαχωρίζεται, σχηματίζει τη μορφή συζευγμένου ιόντος βάσης.
Μπορεί να σας ενδιαφέρει:
- Ισχυρά και ασθενή οξέα και βάσεις.
- Παραδείγματα οξέων και βάσεων.
Χαρακτηριστικά των βάσεων
Στη συνέχεια παρουσιάζουμε τις ιδιότητες των βάσεων ή των αλκαλικών διαλυμάτων που τις χαρακτηρίζουν.
Βασική ικανότητα ιονισμού
Οι βασικές ή αλκαλικές ουσίες χαρακτηρίζονται από σχηματισμό ιόντων όταν διαλύονται σε νερό:

Σε αυτήν την περίπτωση, το υδροξείδιο του νατρίου NaOH ιονίζεται για να σχηματίσει ένα υδροξείδιο ανιόν ΟΗ- και κατιόν νατρίου Na+.
Μια βάση αντιδρά με ένα οξύ για να σχηματίσει ένα άλας
Μια βάση αντιδρά με ένα οξύ σε μια αντίδραση εξουδετέρωσης για να σχηματίσει νερό και ένα άλας, για παράδειγμα:

Σε αυτήν την περίπτωση, το υδροξείδιο αργιλίου Al (OH)3, μια βάση, αντιδρά με HCI και σχηματίζει το άλας χλωριούχου αργιλίου AlCl3 και νερό. Το υδροξείδιο του αργιλίου χρησιμοποιείται ως αντιόξινο για την ανακούφιση της γαστρικής παλινδρόμησης εξουδετερώνοντας το οξύ που παράγεται από το στομάχι.
Βάσεις υδατοδιαλυτότητας
Ορισμένες βάσεις είναι διαλυτές στο νερό. Τα υδροξείδια αλκαλικής γαίας, όπως το υδροξείδιο του ασβεστίου και το υδροξείδιο του βαρίου, είναι ελάχιστα διαλυτά στο νερό. Για παράδειγμα, υδροξείδιο του νατρίου ή καυστική σόδα μπορεί να διαλυθεί 109 g σε 100 ml νερού στους 20ºC. Ενώ το υδροξείδιο του μαγνησίου ή το γάλα μαγνησίας Mg (OH)2 Είναι πρακτικά αδιάλυτο στο νερό.
Βάση ισχύος
Ανάλογα με τον βαθμό ιονισμού της βάσης, αυτές μπορεί να είναι ισχυρές ή αδύναμες. Για παράδειγμα, το υδροξείδιο του λιθίου είναι ένα ισχυρή βάση γιατί σε υδατικό διάλυμα ιονίζεται πλήρως σε ιόντα υδροξειδίου ΟΗ και λιθίου λιθίου+:
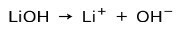
Από την άλλη πλευρά, η αμμωνία NH3 είναι ένα αδύναμη βάση γιατί όταν έρχεται σε επαφή με το νερό, δεν αποσυντίθεται όλη η αμμωνία:
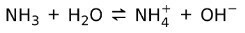
Κατάσταση των Βάσεων
Οι βάσεις βρίσκονται σε στερεές, υγρές και αέριες καταστάσεις. Για παράδειγμα, το καθαρό υδροξείδιο του νατρίου είναι στερεό, η αμμωνία είναι αέριο.
Αντίδραση με το χαρτί litmus των βάσεων
Όταν τοποθετούμε μια λωρίδα χαρτιού σε μια αλκαλική ουσία, το χαρτί γίνεται μπλε.
Προσδιορισμός των βάσεων από το pH τους
Οι βάσεις χαρακτηρίζονται από το ότι έχουν ρΗ μεταξύ 7 και 14.
 Ηλεκτρική αγωγιμότητα των βάσεων
Ηλεκτρική αγωγιμότητα των βάσεων
Οι βάσεις λόγω της ικανότητας ιονισμού τους είναι καλοί αγωγοί ηλεκτρικής ενέργειας. Για παράδειγμα, σε αλκαλικές μπαταρίες, το υδροξείδιο του καλίου KOH χρησιμοποιείται ως ηλεκτρικός αγωγός.
Διαβρωτική επίδραση των βάσεων
Οι ισχυρές βάσεις μπορούν να βλάψουν τους οργανικούς ιστούς. Για παράδειγμα, τα καθαριστικά φούρνων κουζίνας είναι γενικά ισχυρές βάσεις και συνιστάται πάντα να τα χειρίζεστε με εξαιρετική προσοχή, φορώντας γάντια και προστασία των ματιών.
Οι αδύναμες βάσεις σχηματίζουν ένα συζυγές αντίστοιχο
Οι αδύναμες βάσεις όταν διαλύονται σχηματίζουν ένα συζευγμένο αντίστοιχο, δηλαδή, μια ασθενής βάση σχηματίζει ένα συζευγμένο οξύ.
Για παράδειγμα, τρις- (υδροξυμεθυλ) αμινο μεθάνιο (OHCH2)3CNH2 είναι μια ασθενής βάση της οποίας το συζευγμένο οξύ είναι (OHCH2)3CNH3+:
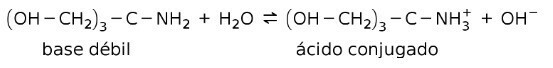
Αυτή είναι η βάση δράσης των ρυθμιστικών ουσιών ή ρυθμιστής, οι οποίες είναι ουσίες που χρησιμοποιούνται για να διατηρούν συνεχώς το pH των διαλυμάτων.
Μπορεί να σας ενδιαφέρει να μάθετε τις διαφορές μεταξύ:
- Οξέα και βάσεις.
- Κατιόντα και ανιόντα


