Positiivsete või negatiivsete ioonide mõiste

Nagu me juba teame, aatomid nende moodustavad subatoomilised osakesed. Kolmest subatomaalsete osakeste tüübist puudub elektrilaeng ainult neutronitel. Selle asemel on prootonitel positiivne elektrilaeng, samal ajal kui elektronidel on negatiivne laeng. Ainult elektronid, mis hõivavad aatomi perifeeria, võivad kanduda ühest aatomist teise, samas kui tuumas olevad prootonid hoiavad nende arvu stabiilsena. Selles ÕPETAJA õppetükis näeme, mis juhtub, kui aatomid või molekulid omandavad või kaotavad elektrone. See tähendab, et me näeme positiivsete või negatiivsete ioonide määratlus ja näited.
Indeks
- Mis on ioonid? Lihtne määratlus
- Ioonide moodustumine: elektro-afiinsus ja elektronegatiivsus
- Mis on negatiivsed ioonid? Näidetega
- Mis on positiivsed ioonid? Näidetega
Mis on ioonid? Lihtne määratlus.
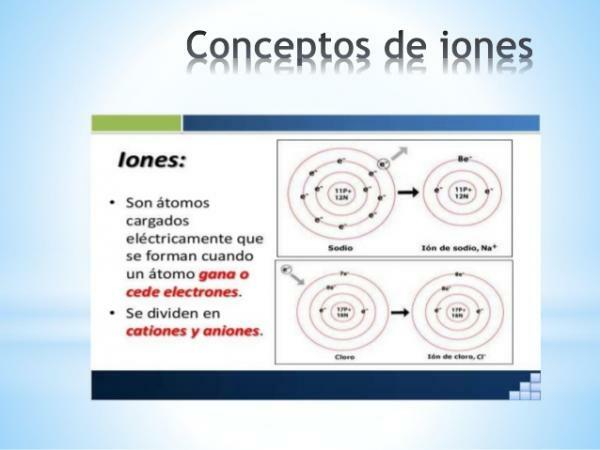
A ioon on ükskõik milline netoelektrilaenguga aatom või molekul. See tähendab, et see on omavahel ühendatud aatom või aatomite kogum, mille elektrilaengud on laetud ei hüvitata
. Selline laengute dekompenseerimine toimub siis, kui üks või mitu elektroni liituvad aatomi või aatomite kogumiga või lahkuvad sellest.Ioonid on seega laetud aatomid või molekulid, elektronide (negatiivse laengu ja tühise massiga subatoomsed osakesed) võimenduse või kadu tõttu.
Ioonitüübid: monatoomiline ja polüatoomiline
Kui arvestada ioonide koostist, eristatakse kahte tüüpi: monatoomilisi ja polüatoomilisi ioone.
- Nagu nimigi ütleb, monatoomilised ioonid need, mis on moodustatud a üksik aatom.
- Ioonsed ühendid o polüatoomilised ioonid on need, milles aatomid on kovalentselt seotud (jagades sidemes ühte või mitut elektronipaari), esitades hulga neutronid molekulis, mis erineb elektronide koguarvust.
- The polüatoomilised ioonid need sisaldavad tavaliselt hapnik ja neil on tavaliselt tsentraalse aatomiga struktuur, mille ümber on paigutatud ülejäänud molekulid, mis moodustavad molekuli.
- The monatoomiliste ioonide laeng tüüpilistest elementidest (tabeli perekonnad 1 ja 2 ning perioodilisustabeli pered 13–17) saab hõlpsasti tuletada, kui nende asukoht perioodilisustabelis on teada. Nendel juhtudel omandavad või kaotavad aatomid elektronid, et jõuda valentskoores selle ajastu väärisgaasi konfiguratsioonini (s2lk6) või mis on sama, täitke okteti reegel.
Pilt: slaidijaotus
Ioonide moodustumine: elektroafiinsus ja elektronegatiivsus.
Aatomite või molekulide võime moodustavad ioone on määratud kahe perioodilise omadusega: elektroafiinsus ja elektronegatiivsus. Mõlema omaduse väärtus tõuseb perioodi jooksul ja väheneb, kui laskume perioodilise tabeli rühma või perekonna kaudu.
The elektroafiinsus, mida nimetatakse ka elektronide afiinsuseks, on aatomi omadus, mis on määratletud kui aatomi võime elektronide ligimeelitamiseks. Ühendite puhul nimetatakse sarnast omadust elektronegatiivsus mis on määratletud kui aatomi võime meelitada elektrone, kui see loob sideme teise aatomiga. Mõlemad omadused määravad seega elemendi kalduvuse elektronide püüdmiseks või kaotamiseks.
Ioonilised sidemed
Tahkel kujul moodustavad ioonid ühendeid või ioonkristallid (soolad), mis on moodustatud erineva märgiga ioonide kombinatsiooniga, mis on ühendatud ioonsed sidemed. Seda tüüpi ühendite tuntuim näide on tavaline sool (naatriumkloriid: NaCl).
Iooniline side koosneb erineva märgiga ioonide ioonidest elektrostaatiliste atraktiivsete jõudude abil (tõmme vastupidise märgi laengute vahel). Seda tüüpi linkidesse sekkuvad elemendid, mille elektronegatiivsus või elektro-afiinsus on väga erinevad (metallilised ja mittemetallilised elemendid). Enamasti on need ioonsed ühendid vees lahustuv ja muud polaarsed lahustid.
Vesilahustes eralduvad ioonsed ühendid vabade ioonidena, mida nimetatakse elektrolüüdid, kuna selle olemasolu lahuses paneb vee käituma elektrijuhina.
Mis on negatiivsed ioonid? Näidetega.
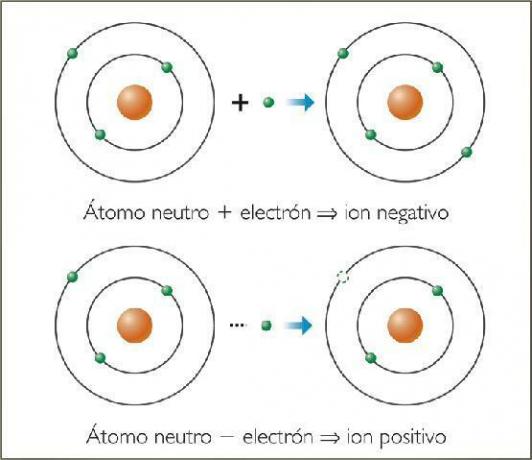
The negatiivsed ioonid Neid nimetatakse anioonid. Kõigil juhtudel on need mittemetalliliste elementide aatomid või molekulid, mis sisaldavad mittemetallilisi elemente. Neid elemente iseloomustab väga kõrge elektroafiinsus ja elektronegatiivsus. Teisisõnu, need on ioonid, mis on moodustatud elementidega suur kalduvus elektronide püüdmisele.
Monatoomilised anioonid: määratlus ja näited
Need on mittemetalsete elementide (perioodilise tabeli rühmad 13–17) aatomite poolt moodustatud anioonid, mis on saanud ühe või mitu elektroni. Nendel anioonidel on ühine väärisgaasi elektrooniline struktuur (id)2lk6) selle äärmises elektronkestas (valentskoor).
Näited:
- Kloriidioon: Cl-
- Fluoriumi ioon: F-
- Ioonjodiid: I-
- Sulfiidioon: S-2
- Nitriidioon: N-3
Polüatoomilised anioonid: määratlus ja näited
Need on negatiivselt laetud ioonid, mis on moodustatud kovalentsete sidemetega ühendatud mittemetalsete elementide kahest või enamast aatomist. Need on kõige tavalisemad polüatoomilised ioonid. Kõige tavalisemad polüatoomilised anioonid on oksoanioonid, mis koosnevad mittemetallist keskaatomist ja sisaldavad hapnikku.
Üldiselt peetakse neid keemilisteks ühenditeks, mis on saadud siis, kui happeline ühend kaotab ühe või mitu prootonit (H+). Need polüatoomilised anioonid võivad oma struktuuris hoida osa vesinikust, mis annab neile teatud happelise iseloomu (võime prootonitest loobuda).
Näited:
- Nitraatioon: NO3-
- Permanganaadi ioon: MnO4-
- Fosfaatioon: PO4-3
- Vesinikkarbonaat- või vesinikkarbonaatioon: HCO3-
- Sulfiitioon: SO3-2
Pilt: loodusravi
Mis on positiivsed ioonid? Näidetega.
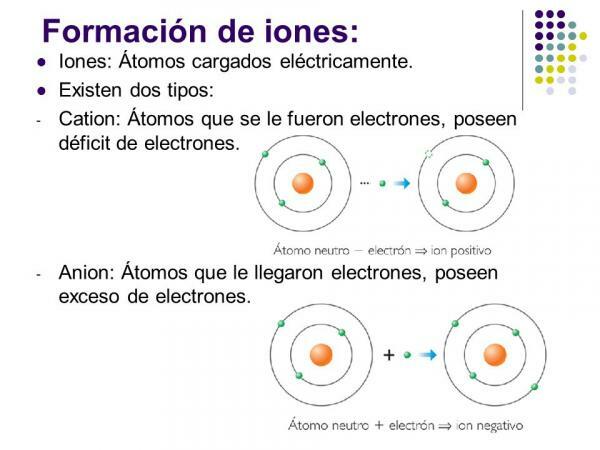
Positiivseid ioone nimetatakse ctused. Peaaegu kõikidel juhtudel on need metalliliste elementide aatomid või molekulid, mis sisaldavad metallilisi elemente. Neid elemente iseloomustab väga madal elektro-afiinsus ja elektronegatiivsus, mistõttu neil on selge tendents elektronide kaotamiseks.
Monatoomsed katioonid: määratlus ja näited
Need on positiivse laenguga (elektronide kadumise tõttu) ioonid, mis on moodustatud metallelemendi üheaatomist. Sellisel juhul moodustub katioon elektronide kadumisest, mis võimaldavad elemendil tühjendada oma välimine elektrooniline kiht ja omandada väärisgaasi konfiguratsiooni (d)2lk6) madalamalt tasemelt. Nad on kõige tavalisem katioonitüüp.
Näited:
- Vesinik või hüdroonkatioon (nimetatakse ka prootoniks): H+
- Naatriumkatioon: Na+
- Raud (III) katioon või raudkatioon: Fe+3
- Kaltsiumkatioon: Ca+2
- Vask (II) või vaskkatioon: Cu+2
Polüatoomilised katioonid: määratlus ja näited
Polüatomilised katioonid on need, mis on moodustatud kahest või enamast aatomist. Neid on harva, kõige rohkem on nn homopolüatoomilisi katioone, mis sisaldavad rohkem kui ühte sama elemendi aatom, trihüdrogeenioooni korral on see üks kõige levinumaid molekule universum. Erinevate elementide aatomitest moodustunud polüatoomsed katioonid pole levinud, kuid neid iseloomustavad vesiniku olemasolu ja seda peetakse siis, kui aluseline ühend haarab prootoni (H+).
Näited:
- Ammooniumkatioon: NH4+
- Oksooniumkatioon: HO3+
- Fosfooniumkatioon: PH3+
- Trihüdrogeenkatioon või protoneeritud molekulaarne vesinik: H3+
- Maavärvi katioon: Hg2+2
Pilt: planeedid
Kui soovite lugeda rohkem artikleid, mis on sarnased Negatiivsed ja positiivsed ioonid: määratlus ja näited, soovitame sisestada meie kategooria Aatom.
Bibliograafia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Põhikeemia. Madrid: Uned
