10 keemiliste sidemete tüüpi (selgitatud näidetega)
Keemilised sidemed on jõud, mis hoiavad koos aatomeid molekulide moodustamiseks. Aatomite vahel on kolme tüüpi sidemeid:
- Metalliline side.
- Iooniline side.
- Kovalentne side: mittepolaarne, polaarne, lihtne, topelt-, kolmekordne, dateeriv.
Tänu nendele sidemetele moodustuvad kõik looduses eksisteerivad ühendid. Samuti on jõude, mis hoiavad molekule koos, tuntud kui molekulidevahelised sidemed, näiteks:
- Vesiniksidemed või sillad.
- Dipool-dipool jõud.
Järgmisena selgitame kõiki neid linke.
| Keemilise sideme tüübid | Iseloomulik | Näited | |
|---|---|---|---|
| Metallist | Metalliioonid hõljuvad liikuvate elektronide meres. | Metallilised elemendid: naatrium, baarium, hõbe, raud, vask. | |
| Iooniline | Elektronide ülekandmine ühest aatomist teise. | Na naatriumkloriid+Cl- | |
| Kovalentne | Mittepolaarne | Jagage elektrone kahe aatomi vahel võrdselt. | Molekulaarne vesinik H-H või H2 |
| Polaarne | Jagage elektrone ebaühtlaselt kahe aatomi vahel. | Veemolekul H2VÕI | |
| Lihtne | Jagage elektronide paari. | Kloormolekul Cl2 Cl-Cl | |
| Topelt | Jagage kahte elektronide paari. | Hapniku molekul O2 O = O | |
| Kolmekordne | Jagage kolme elektronide paari. | Lämmastikumolekul N≣N või N2 | |
| Datiiv | Ainult üks aatomitest jagab elektrone. | Ühend lämmastiku ja boori vahel ammoniaagi-boori trifluoriidis. | |
| Molekulidevahelised jõud | Vesinikusild | Ühes molekulis olevad vesinikud tõmbuvad teise molekuli elektronegatiivsete aatomite poole. | Vesinik seob ühe veemolekuli vesiniku ja teise veemolekuli hapniku vahel. |
| Dipool-dipool | Kahe elektrilise poolusega molekulid meelitavad teiste molekulide vastandpoolusi. | Koostoimed metanaali H molekulide vahel2C = O |
Metalliline side
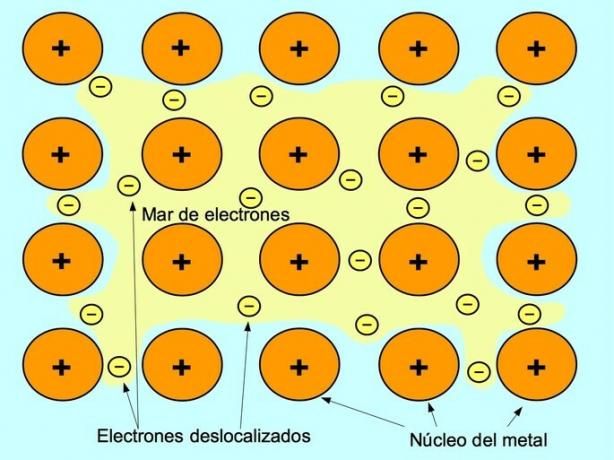
Metalliline side on metallelementide positiivsete ioonide ja ioonide vahel vabalt liikuvate negatiivsete elektronide vaheline tõmbejõud. Metalli aatomid on tihedalt kokku pakitud, see võimaldab elektronidel liikuda aatomite võre piires.
Metallides vabanevad valentselektronid nende algsest aatomist ja moodustavad elektronide "mere", mis hõljub kogu metallkonstruktsiooni ümber. See põhjustab metalli aatomite muundumise positiivselt laetud metalliioonideks, mis pakenduvad kokku.
Metalliline side on loodud selliste metallelementide vahel nagu naatrium Na, baarium Ba, kaltsium Ca, magneesium Mg, kuld Au, hõbe Ag ja alumiinium Al.
Iooniline side
Iooniline side on jõud, mis ühendab metallilise elemendi, näiteks naatriumi või magneesiumi, mittemetallilise elemendiga, näiteks kloori või väävliga. Metall kaotab elektronid ja muundub positiivseks metalliiooniks, mida nimetatakse katioon. Need elektronid lähevad üle mittemetalsele elemendile ja see muundub negatiivselt laetud iooniks, mida nimetatakse anioon.
Katioonid ja anioonid ühendavad ja moodustavad kolmemõõtmelise võrgu, mida hoiavad erinevate laengutega ioonide vahelised elektrostaatilise tõmbejõud. Need jõud moodustavad ioonseid ühendeid.
Maapõue koosneb peamiselt ioonsetest ühenditest. Enamik kivimeid, mineraale ja vääriskive on ioonsed ühendid. Näiteks:
- Naatriumkloriid NaCl: metalliline element on naatrium, mis kannab elektroni kloori, mis on mittemetalliline element.
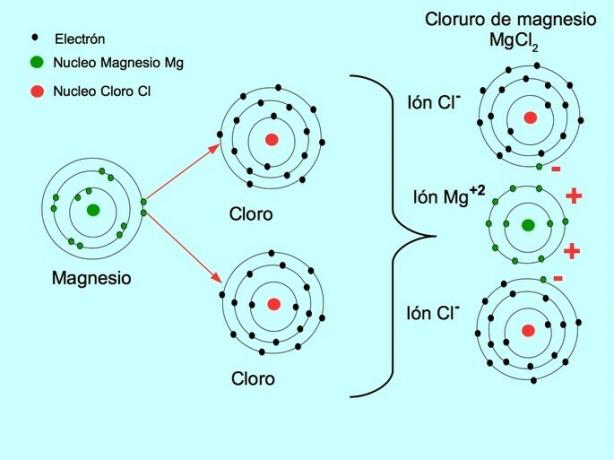
- Magneesiumkloriid MgCl2: Magneesium Mg annetab kahele klooriaatomile kaks elektroni, nagu on näidatud alloleval joonisel:
Vaata ka Katioonide ja anioonide erinevus.
Kovalentne side
Kovalentne side tekib siis, kui kaks mittemetallilist aatomit jagavad elektrone. See side võib olla mitut tüüpi, sõltuvalt afiinsusest aatomite elektronide suhtes ja jagatud elektronide hulgast.
Mittepolaarne kovalentne side
Mittepolaarne kovalentne side on side, mis tekib kahe aatomi vahel, kus elektrone jagatakse võrdselt. See side tekib tavaliselt sümmeetrilistes molekulides, see tähendab kahest võrdsest aatomist koosnevatel molekulidel, näiteks vesinikmolekul H2 ja hapniku molekul O2.

Polaarne kovalentne side
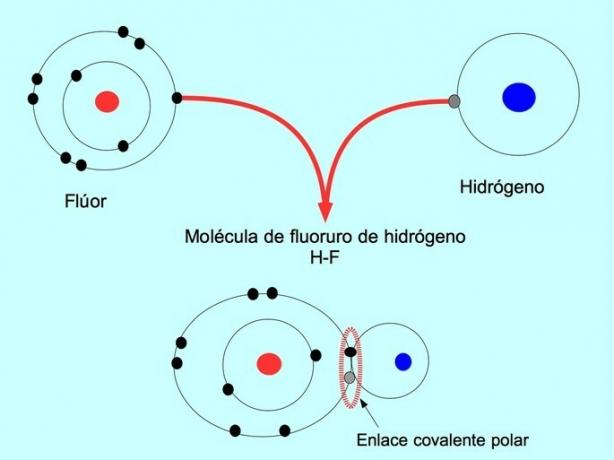
Polaarne kovalentne side tekib siis, kui kaks aatomit jagavad elektrone, kuid ühel neist on suurem elektronide ligitõmbavus. See muudab molekuli negatiivsema "pooluse", kus on rohkem elektrone, ja vastaspool on positiivsem.
Sellise elektronide jaotuse või tasakaalustamatusega molekule nimetatakse polaarseteks. Näiteks vesinikfluoriid-HF-s on vesiniku ja fluori vahel kovalentne side, kuid fluoril on suurem elektronegatiivsus, nii et see meelitab elektrone tugevamalt jagatud.
Lihtne kovalentne side
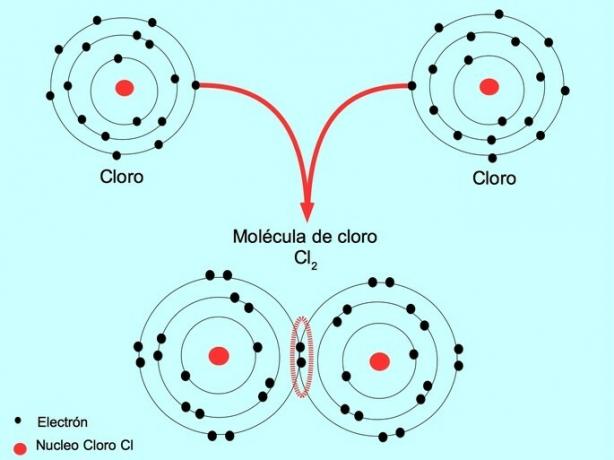
Kui kahel aatomil on kaks elektroni, üks kummalgi, nimetatakse moodustunud kovalentset sidet lihtsaks kovalentseks sidemeks.
Näiteks on kloor aatom, mille väliskestas on seitse valentselektroni, mida saab täita kaheksa elektroniga. Kloor võib ühineda teise klooriga, moodustades kloori molekuli Cl2 mis on palju stabiilsem kui ainult kloorid.
Topeltkovalentne side
Kahekordne kovalentne side on side, kus neli elektroni (kaks paari) elektrone jagunevad kahe aatomi vahel. Näiteks hapniku viimases kestas on 6 elektroni. Kahe oksügeeni ühendamisel jagatakse nende kahe vahel neli elektroni, mille tagajärjel kummalgi on viimases kestas 8 elektroni.
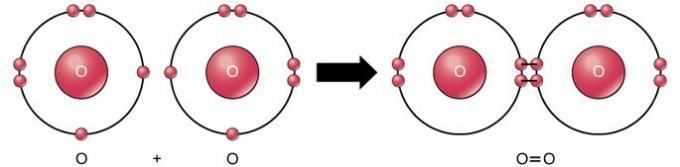
Kolmekordne kovalentne side
Kolmekordne kovalentne side tekib siis, kui 6 elektroni (või kolm paari) on jagatud kahe aatomi vahel. Näiteks vesiniktsüaniidi molekulis HCN moodustub süsiniku ja lämmastiku vahel kolmikside, nagu on näidatud allpool toodud joonisel:
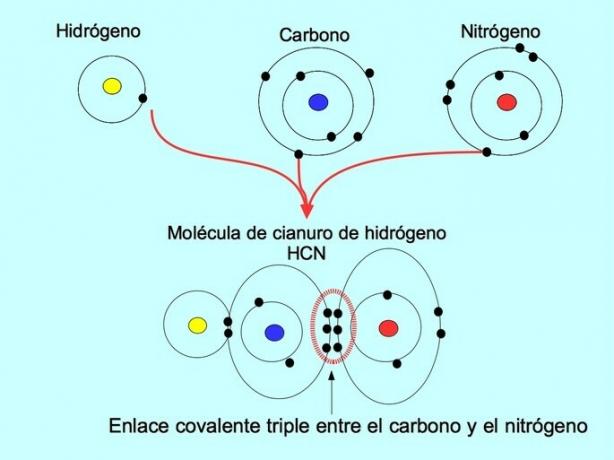
Koordinaat ehk dateeriv kovalentne side
Koordineeritud või datatiivne kovalentne side on side, mis tekib siis, kui ainult üks sideme aatomitest panustab elektronipaari. Näiteks kui ammoniaak NH reageerib3 boortrifluoriidiga BF3Lämmastik seondub kahe elektroniga otse booriga, mille jagamiseks pole ühtegi elektroni saadaval. Nii jäävad nii lämmastik kui boor valentskooresse 8 elektroniga.
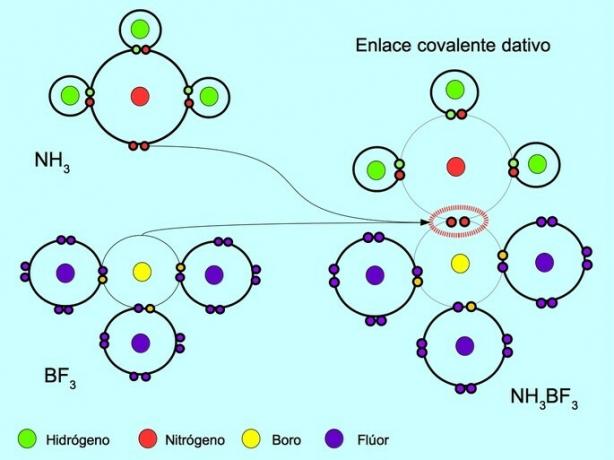
Vaata ka Orgaanilised ja anorgaanilised ühendid.
Molekulidevahelised lingid
Molekulid seonduvad jõudude kaudu, mis võimaldavad moodustada aineid vedelas või tahkes olekus.
Dipool-dipoolsidemed või -jõud
Nõrgad molekulidevahelised sidemed võivad tekkida polaarmolekulide vahel, kui negatiivseid pooluseid meelitatakse positiivsete pooluste poole ja vastupidi. Näiteks metanaal H2C = O on polaarne molekul, osaliselt negatiivse laenguga hapnikul ja osaliselt positiivse laenguga vesinikel. Ühe metanaalse molekuli positiivne külg meelitab teise metanaali molekuli negatiivset külge.
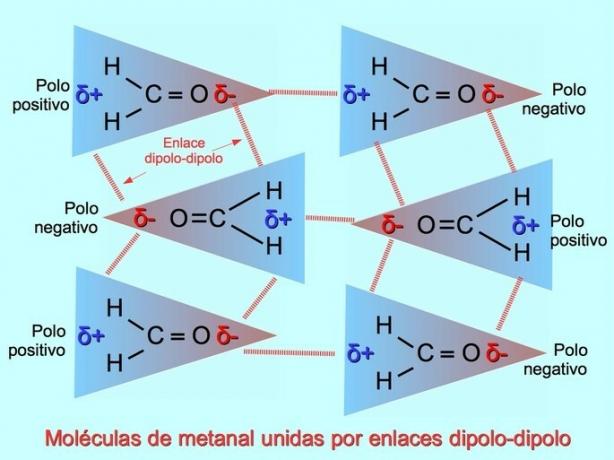
Vesiniksidemed või sidemed
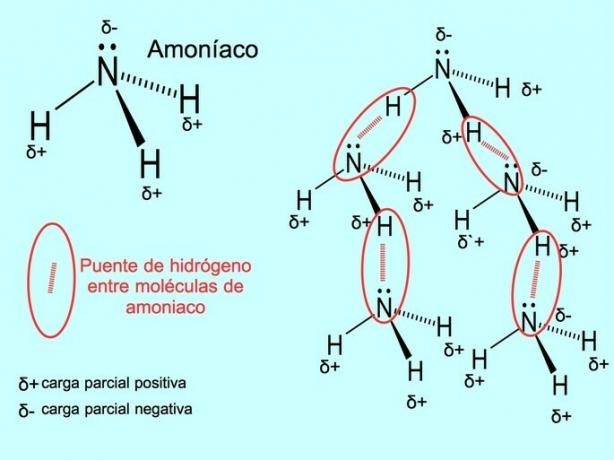
Vesinikside või vesinikside on side, mis tekib molekulide vahel. See tekib siis, kui molekuli vesinik on kovalentselt seotud hapniku, lämmastiku või fluoriga. Hapnik, lämmastik ja fluor on suurema elektronegatiivsusega aatomid, seetõttu meelitavad nad elektrone tugevamalt, kui jagavad neid teise vähem elektronegatiivse aatomiga.
Veemolekulide H vahel on vesiniksidemed2O ja ammoniaak NH3 nagu pildil on näha:
Teil võib olla huvi näha:
- Aatomid ja molekulid.
- Orgaaniliste ja anorgaaniliste ühendite näited.
- Metallid ja mittemetallid
Viited
Zumdahl, S.S., Zumdahl, S.A. (2014) keemia. Üheksas väljaanne. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Keemia 1. 5. väljaanne. Pearson Austraalia. Melbourne.


