Aatomi ja molekuli erinevused

Pilt: vastab näpunäidetele
The asja koosneb rea elementidest, sealhulgas aatomid ja molekulid. Viimased moodustuvad kahe või enama aatomi liitumisel keemiliste sidemete kaudu. Kõik, mis hõivab koha või koha ruumis, on aine ja seetõttu on sellel mass.
Materiaalsüsteemid koosnevad aatomitest ja molekulidest, viimased koosnevad aatomitest, mis on omavahel ühendatud tänu keemilistele sidemetele. Järgmisena näeme selles unPROFESOR.com-i õppetundis lihtsal õppimisviisil järgmist erinevused aatomi ja molekuli vahel.
Sõna aatom pärineb iidsest Kreeka terminist, mis määratleb a aineosake nii väike, et seda ei saa enam jagada. 19. sajandi alguses määratles Briti keemik John Dalton aatomi juba elemendi väikseima osakesena, mis säilitab keemilised omadused.
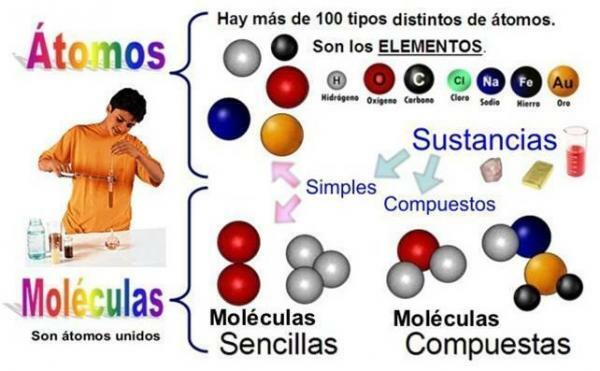
Seetõttu on aatomid elemendi väikseim osa, mis võib keemilises reaktsioonis osaleda. Mateeria koosneb nendest jagamatutest osakestest ja erinevate keemiliste elementide aatomitest võivad molekule moodustades seonduda.
Millest aatomid koosnevad?
Aatom on nagu väike päikesesüsteem, mis koosneb a-st
Ajukoor või äärealad ja tuum. Koorest leiame elektronid, tuuma ümber pöörlev. Neil on negatiivne elektrilaeng. Omalt poolt prooton ja neutron moodustavad tuuma, mis on ühiselt nimetatud nukleonid. Esimeste mass on väga väike ja positiivne elektrilaeng ning neutronil pole laengut ja väike mass.Erinevat tüüpi aatomid
Sees neutraalne aatom leiame, et elektronide arv on sarnane prootonite arvuga, kompenseerides negatiivse elektrilaengu. Kuna võrdsed elektrilaengud tõrjuvad üksteist, prootonid nad tunnevad elektrostaatilist tõrjumist, kuid neid hoiab koos võimsama jõu olemasolu, mida nimetatakse tugev tuumaenergia. Suurimal määral leitakse aatomi mass tuumas, kuna elektronide mass on 1835 korda väiksem kui neutronil ja prootonil.
Võib leida mitut tüüpi aatomeid, tegelikult on neid nii palju kui keemilisi elemente, see tähendab, et neid on rohkem kui sada. Kõik sama elemendi aatomid on üksteisega võrdsed ja erinevad teiste elementide omadest. See eristamine põhineb prootonite arvul oma tuumas, mida nimetatakse ‘aatomnumbriks’ ja mida tähistab täht Z.
Aastal Perioodilisustabel leiate elemendid, mis on järjestatud vastavalt nende aatomnumbrile. Näiteks vesiniku (H) aatomnumber on 1, kuna selle tuumas on prooton; või kloor (Cl) on 17, kui sellel on kaks prootonit. See loodi aatomite järjestamiseks ja klassifitseerimiseks, leides korrektselt kõik olemasolevad klassid ja neid on umbes 105.

Pilt: slaidijaotus
Molekulidena mõistame väiksemad aineosakesed, mida kombineeritult nimetatakse keemiliseks ühendiks. Seetõttu oleks see väikseim osake, mis võib ühendina eksisteerida. Need on moodustatud aatomite liit.
Seega, kui kaks või enam sama või erineva elemendi aatomit saavad kokku keemilised sidemed Selle tulemuseks on keemilise ühendi molekul. Näiteks koosneb osoon kolmest hapnikuaatomist (O3).
The puhtad ained Need on need, mille moodustavad üks klass molekulid, mis kõik on võrdsed. Seevastu ühend koosneb mitut tüüpi molekulide seeriast. Molekuli moodustavad aatomid oleksid puhaste ainete moodustumisel samad ja ühendite puhul erinevad.

The erinevused aatomi ja molekuli vahel Kõige olulisemad on, et endine vormiaine ja molekulid koosneksid erinevatest aatomitest, mis kokku tulevad. Kui peaksime paralleeli tegema maja ehitusega, oleksid aatomid hoone tellised, molekulid aga tellistest ehitatud seinad.
Aatomid ei eksisteeri looduses individuaalselt, kuna need on alati seotud teiste elementidega, samas kui molekul võib eksisteerida individuaalselt, olles võimeline leidma hapnik, kloor, jne.
Pilt: ccnn2016 - blogija
Kui soovite lugeda rohkem artikleid, mis on sarnased Aatomi ja molekuli erinevused - hõlpsasti uuritav!, soovitame sisestada meie kategooria Aatom.
