Erinevus endotermiliste reaktsioonide ja eksotermiliste reaktsioonide vahel
A endotermiline reaktsioon nõuab jõudu, samal ajal kui a eksotermiline reaktsioon vabastab energiat. Selles keemiliste reaktsioonide klassifikatsioonis võetakse arvesse energia osalemist kas reagendina või tootena.
Energia on võime tööd teha või soojust toota. Pidage meeles, et keemilised reaktsioonid hõlmavad aatomite ümberkorraldamist ainete vahel, purunedes või moodustades keemilisi sidemeid. Üldiselt kaasnevad selle keemiliste sidemete tekke või purunemisega muutused süsteemi energias.
| Endotermiline reaktsioon | Eksotermiline reaktsioon | |
|---|---|---|
| Definitsioon | Keemiline reaktsioon, kus energia neeldub. | Keemiline reaktsioon, kus energia eraldub soojuse kujul. |
| Energia päritolu | Keskkonnast | Süsteemist |
| Potentsiaalne energia | Reagentides vähem kui toodetes. | Reagentides rohkem kui toodetes. |
| Tootmine | Pole spontaanne | Spontaanne |
| Sisemine energia muutus | ΔE> 0; siseenergia muutus suurem kui null. | AE <0; siseenergia muutus on väiksem kui null. |
| Temperatuur | Väheneb | Suureneb |
| Näited | Reaktsioonid fotosünteesis ja sünteesis üldiselt. | Põletav tikk, põlemisreaktsioonid. |
Mis on endotermiline reaktsioon?
Keemiline reaktsioon on endotermiline, kui neelab keskkonnast energiat. Sellisel juhul viiakse soojus süsteemi väljastpoolt sisemusse. Kui asetame termomeetri endotermilise reaktsiooni toimumise ajal, langeb temperatuur.
Sõna "endotermiline" tuleneb kreeka keelest endon mis tähendab "sees" ja terme mis tähendab "soojust". Endotermilised reaktsioonid ei kulge spontaanselt.
Kust tuleb energia endotermilistes reaktsioonides?
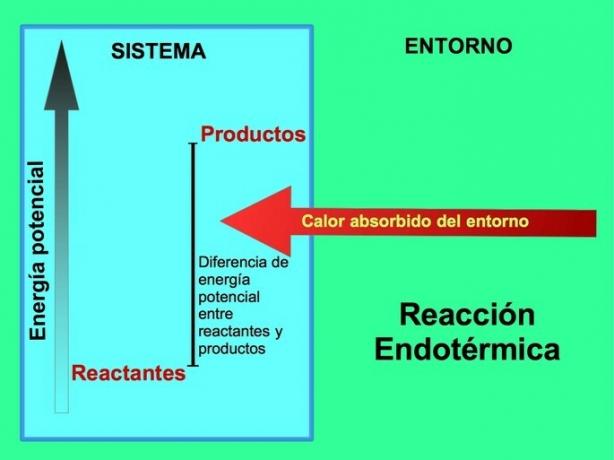
Endotermiliste reaktsioonide korral tuleb energia süsteemist väljaspool asuvast keskkonnast. Toodete potentsiaalse energia hulk on suurem kui reagentide potentsiaalne energia. Seetõttu on reaktsiooni jätkamiseks vaja lisada reagentidele energiat. See energia tuleb keskkonna kuumusest.
Näiteks, fotosüntees on endotermiline protsess, kus taimed koguvad päikeseenergiat, et toota süsinikdioksiidist ja hapnikust glükoosi:

Fotosünteesireaktsiooni produktidel, glükoosil ja hapnikul, on reaktiivide, süsinikdioksiidi ja vee suhtes suurem potentsiaalne energia. Teised näited endotermilistest keemilistest reaktsioonidest kasutatud energia kogusega:

Endotermilise reaktsiooni näited
Reaktsioonid tekivad mitte ainult keemialaboris. Igapäevaselt leiame ka olukordi, kus tekivad endotermilised reaktsioonid.
Toidu valmistamine
Kuigi see ei pruugi tunduda, on toidu valmistamise protsess endotermiline. Teatud toitude tarbimiseks peame andma sooja.
Kiire külmkott
Muhkude või nikastuste raviks kasutatavad külmapakid täidetakse veega, kuid raputades või koputades puruneb sees ammooniumnitraati sisaldav kapsel. Ammooniumnitraadi segamine veega on endotermiline reaktsioon, mis põhjustab koti jahtumise.
Võite olla huvitatud Soojuse ja temperatuuri erinevus.
Mis on eksotermiline reaktsioon?
A eksotermiline reaktsioon on selline, kus energia voolab süsteemist välja. See energia eraldub soojuse kujul, nii et termomeetri paigutamine reaktsioonisüsteemi suurendab temperatuuri.
Sõna "eksotermiline" moodustub eksole mis tähendab "väljapoole" ja termid, mis tähendab "soojust". Eksotermilised reaktsioonid võivad tekkida spontaanselt ja mõnel juhul võivad olla plahvatusohtlikud, näiteks leelismetallide ja vee kombinatsioon.
Kust tuleb energia eksotermilistes reaktsioonides?
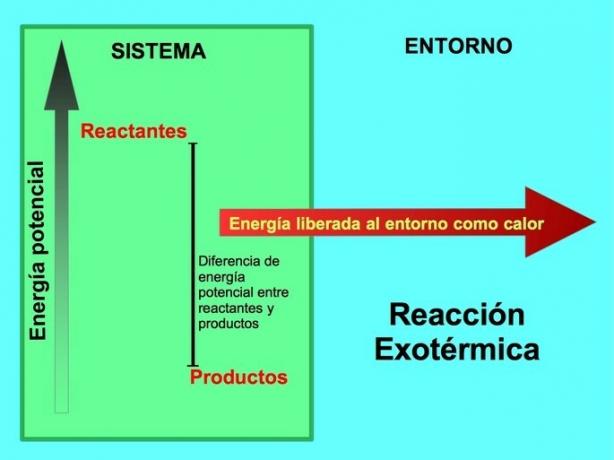
Keemilises reaktsioonis on reaktandid ühendid, mis muundavad ja annavad tooteid. Näiteks kui naatrium Na reageerib kloor Cl-ga, on need reagendid ja produktiks on naatriumkloriidi NaCl:

Nii reaktandid kui ka tooted on potentsiaalset energiat salvestanud. Me teame lenergiasääst silm seda energiat ei kaotata ega saada, seega peab reagentide energia olema võrdne saaduste energiaga.
Eksotermilises reaktsioonis lreagentidel on toodetega võrreldes rohkem potentsiaalset energiat, nii et liigne energia eraldub soojuse kujul. Sel juhul loetakse energiat ka toodete osaks:

Igas eksotermilises protsessis muundatakse osa keemilistesse sidemetesse salvestunud potentsiaalsest energiast soojusenergiaks.
Eksotermilise reaktsiooni näited
Pesu pesemisvahend
Kui lahustame oma kätes veega väikese pulbri pesuvahendi, võime tunda kerget kuumenemist.
Kodumajapidamises kasutatava gaasi põletamine
Kodumajapidamises kasutatavate gaaside, näiteks metaani või butaani, põletamine hõlmab keemilist reaktsiooni hapnikuga süsinikdioksiidi ja vee moodustumisel ning energia vabanemist. See on tüüpiline eksotermiline reaktsioon igapäevases kasutuses:
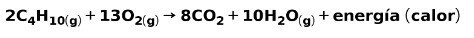
Põlemisprotsessis eralduv energia kulub toidu valmistamiseks.
Samuti võite olla huvitatud teadmisest, mis need on Avatud süsteem, suletud süsteem ja isoleeritud süsteem.



