Hapete ja aluste omadused: peamised erinevused
Hapete ja aluste omadused on kõik need omadused ja omadused, millega saame eristada hapet ja alust.
Arrehniuse teooria kohaselt a hape on aine, mis vabastab prootoneid H+ vees lahustatuna ja a alus on mis tahes aine, mis eraldab hüdroksüülioone OH- vesilahuses.
| Happed | Alused | |
|---|---|---|
| Ioonide moodustumine | Kohal | Kohal |
| Neutraliseerimisreaktsioon | Kui see reageerib alusega. | Kui see reageerib happega. |
| Lahustuvus vees | Lahustuv | Osaliselt lahustuv. Kaltsiumi-, baariumi- ja alumiiniumhüdroksiidid lahustuvad halvasti. |
| Elektrijuhtivus | Kohal | Kohal |
| Mateeria olek | Tahke, vedel või gaasiline | Tahke, vedel või gaasiline |
| Reaktsioon lakmuspaberiga | Punane värv | Sinine värv |
| PH väärtus | Alla 7 | Suurem kui 7 |
| Konjugeeritud kolleeg | Nõrk hape moodustab konjugaataluse. | Nõrk alus moodustab konjugeeritud happe. |
| Sööbiv toime | Tugevad happed | Tugevad alused |
Hapete omadused
Hapetel on mitu tunnust, mille järgi neid saab identifitseerida.
Oskus moodustada hapetest ioone
Happeliste ainete peamine omadus on see, et neid saab ioniseerida, see tähendab kaotada või omandada elektrone.
Vesinikkloriidhape HCl, tugev hape, ioniseerub, moodustades kloriidioonioon Cl- ja prooton H+.
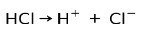
Neutraliseerimisreaktsioon
Hape reageerib alusega, moodustades soola ja vee. See reaktsioon on tuntud kui neutraliseerimisreaktsioon. Näiteks reageerib HCl NaOH-ga, moodustades naatriumkloriidi NaCl (köögisool) ja vee:
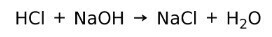
Hapete lahustuvus vees
Happed lahustuvad tavaliselt vees. Näiteks vesinikkloriidhape või muriatsiinhape lahustub mõõdukalt vees, kuni 82 g HCl võib lahustada 100 ml vees temperatuuril 0 ° C. Väävelhappe korral H2SW4, segu veega tekitab soojust, seetõttu on plahvatuste vältimiseks alati soovitatav hape vette lisada.
Happe tugevus
Kuidas happed dissotsieeruvad, määrab kindlaks, kas need on tugevad või nõrgad. Happe tugevuse annab selle dissotsiatsioonikonstant.
Lämmastikhape HNO3 see on tugev hape kuna vesilahuses ioniseerub see täielikult prootoniteks ja nitraadiioonideks:

See tähendab, et kui lisame HNO3 vees leiame vett analüüsides ainult H+ ja nitraadiioonid ning praktiliselt puudub HNO3.
Selle asemel on äädikas leiduv äädikhape a nõrk hape, sest ainult osa sellest on eraldatud:
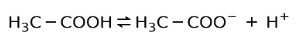
Sellepärast on seda kujutatud nooltega kahes suunas, see tähendab, et vesilahuses on meil äädikhape H+ ja atsetaatanioon (H3C-COO-).
Hapete aine olekud
Happeid võib leida vedelas, tahkes või gaasilises olekus. Näiteks vesinikkloriidhappe HCl on vedel, vesiniksulfiid HS on gaas ja oblikhape on tahke aine.
Reaktsioon hapetest pärit lakmuspaberiga

Kui asetame lakmuspaberi riba happelisse ainesse, muutub lakmuspaber punaseks.
Hapete tuvastamine nende pH järgi
PH on H hulga mõõt+ lahuses. Seega oleme pH vahemikus 0 kuni 7 happe juuresolekul. Näiteks äädika pH on võrdne 2, väävelhappe pH autoakudes võrdub 1-ga.
Hapete elektrijuhtivus
Kuna happed võivad dissotsieeruda ja tekitada elektriliselt laetud ioone, võivad happelised lahused juhtida elektrit. Näiteks kasutatakse autoakude sees väävelhapet, mis on tugev hape, elektrijuhina.
Tugevate hapete söövitav toime
Tugevatel hapetel on söövitav toime, nad võivad orgaanilisi kudesid põletada, mistõttu nende käitlemine peab olema äärmiselt ettevaatlik.
Nõrgad happed moodustavad konjugeeritud vaste
Lahustudes moodustavad nõrgad happed nn konjugaadipaari, see tähendab, et nõrk hape moodustab konjugaataluse.
Näiteks:

Sellisel juhul moodustab sipelga- või metaanhape (HCOOH) dissotsieerudes konjugeeritud aluse ioonformaadi.
See võib teile huvi pakkuda:
- Tugevad ja nõrgad happed ja alused.
- Hapete ja aluste näited.
Aluste omadused
Järgnevalt tutvustame neid iseloomustavate aluste või leeliseliste lahuste omadusi.
Aluse ionisatsioonivõime
Aluselisi või aluselisi aineid iseloomustab ioonide moodustumine vees lahustatuna:

Sel juhul ioniseerub naatriumhüdroksiid NaOH, moodustades hüdroksiidanioon OH- ja naatriumkatioon Na+.
Alus reageerib happega, moodustades soola
Alus reageerib neutraliseerimisreaktsioonis happega, moodustades näiteks vee ja soola:

Sellisel juhul on alumiiniumhüdroksiid Al (OH)3, alus reageerib HCl-ga ja moodustab alumiiniumkloriidsoola AlCl3 ja vesi. Alumiiniumhüdroksiidi kasutatakse antatsiidina mao tagasivoolu leevendamiseks mao toodetud happe neutraliseerimise teel.
Põhistab vees lahustuvust
Mõned alused lahustuvad vees. Leelismuldmetalli hüdroksiidid, näiteks kaltsiumhüdroksiid ja baariumhüdroksiid, lahustuvad vees halvasti. Näiteks naatriumhüdroksiidi või seebikivi võib lahustada 109 g 100 ml vees temperatuuril 20 ºC. Kuigi magneesiumhüdroksiid või magneesiumpiim Mg (OH)2 see on vees praktiliselt lahustumatu.
Aluse tugevus
Sõltuvalt aluse ionisatsiooniastmest võivad need olla tugevad või nõrgad. Näiteks liitiumhüdroksiid on a tugev alus kuna vesilahuses ioniseerub see täielikult hüdroksiidioonideks OH ja liitium-Li-katioonideks+:
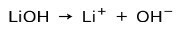
Teiselt poolt ammoniaak NH3 on nõrk alus sest kokkupuutel veega ei eraldu kogu ammoniaak:
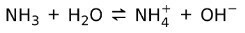
Baaside olek
Aluseid võib leida tahkes, vedelas ja gaasilises olekus. Näiteks puhas naatriumhüdroksiid on tahke, ammoniaak on gaas.
Reaktsioon aluste lakmuspaberiga
Kui asetame lakmuspaberi riba leeliselisse ainesse, muutub paber siniseks.
Aluste identifitseerimine nende pH järgi
Aluseid iseloomustab pH vahemikus 7 kuni 14.
 Aluste elektrijuhtivus
Aluste elektrijuhtivus
Alused on nende ionisatsioonivõime tõttu head elektrijuhid. Näiteks leelispatareides kasutatakse elektrijuhina kaaliumhüdroksiidi KOH.
Aluste söövitav toime
Tugevad alused võivad kahjustada orgaanilisi kudesid. Näiteks on köögiahjude puhastusvahendid üldiselt tugevad alused ja neid soovitatakse alati käsitseda äärmise ettevaatusega, kandes kindaid ja silmakaitset.
Nõrgad alused moodustavad konjugaadi vaste
Lahustunud nõrgad alused moodustavad konjugeeritud vaste, see tähendab, et nõrk alus moodustab konjugeeritud happe.
Näiteks tris- (hüdroksümetüül) aminometaan (OHCH2)3CNH2 on nõrk alus, mille konjugeeritud hape on (OHCH2)3CNH3+:
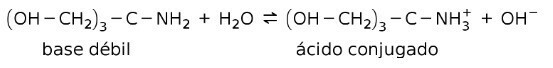
See on puhverainete või puhver, mis on ained, mida kasutatakse lahuste pH pidevaks hoidmiseks.
Võib-olla olete huvitatud järgmiste erinevuste tundmisest:
- Happed ja alused.
- Katioonid ja anioonid


