10 tüüpi keemilisi elemente (selgitatud ja klassifitseeritud)
Mitu keemilist elementi peab universumis eksisteerima? Sellel küsimusel on veel pikk tee minna, sest teadlased loovad aeg -ajalt oma kunstlikke keemilisi elemente.
Sellele saame aga vastata kui palju keemilisi elemente peab eksisteerima, midagi, mida saame teada järgmisena.
- Seotud artikkel: "11 tüüpi keemilisi reaktsioone"
Keemiliste elementide tüübid
Looduses võime leida igasuguseid aineid. Neid aineid ei leidu tavaliselt puhtal kujul, vaid need on erinevate kombinatsioonide tulemus elemente või materjale, mis erinevate reaktsioonide, protsesside ja ajaperioodide jooksul on tekitanud igasuguseid asja. Universumis pole midagi, mis ei oleks erinevat tüüpi keemiliste elementide aatomite kombinatsiooni tulemus, mida me kavatseme põhjalikult näha.
Enne keemiliste elementide tüüpide vaatamist teeme siiski väikese ülevaate keskkooli teadusest ja meenutame, mis on keemilised elemendid.
Me nimetame "keemilise elemendi" aineks, mis koosneb sama tüüpi aatomist, see tähendab aatomiliselt puhtast ainest.
Keemilisi elemente ei saa lagundada lihtsamaks ja need klassifitseeritakse perioodilisustabelisse elemente kui universumi puhtaid materjale.Kuid ole ettevaatlik! me ei tohiks segi ajada elemente lihtsate ainetega, sest teatud juhtudel võivad sama elemendi kaks või enam aatomit moodustada molekulid, mis on rühmitatud erineval viisil ja mis põhjustavad kõnealuse elemendi mõned füüsikalised omadused varieerumist isotoobid. Näiteks teemant ja süsinik on ained, mis on valmistatud keemilisest elemendist süsinik (C). kuid see on korraldatud erineval viisil ja tulemuseks on kaks täiesti erinevat materjali.
Carl sagan Ta ütles, et me oleme tähepuru, mis peegeldab tähti. See ilus fraas ei ole pelgalt metafoor, vaid teaduslik fakt. Keemilised elemendid tekivad meile teadaolevalt tähtede sees keerukuse tagajärjel termotuumasünteesi ja aatomi lõhustumise protsessid, mis tekitavad üha raskemaid elemente, protsessi tulemusel nukleosüntees.
Enamiku teadaolevatest elementidest saab loodusest, mis leiti spontaanselt või moodustades ühendeid teiste elementidega, nagu uraan (U), süsinik (C), räni (Si), hõbe (Ag) või kuld (Au). Teisi seevastu on toodetud laborites nagu americium (Am), berkeelium (Bk) või curium (Cm). Ükskõik, millisel meetodil seda saadakse või kui see on looduses olemas, on kõnealusel keemilisel elemendil sõltuvalt selle omadustest teatud või teised kasutusalad.
Praegu on teada umbes 118 keemilist elementi, kuigi kui võtta arvesse, et inimesed on suutnud uusi elemente toota, on aja küsimus, millal perioodiline tabel laieneb.
- Teid võib huvitada: "Kaks elektritüüpi (selgitatud)"
Peamised keemiliste elementide tüübid
Peamised keemiliste elementide tüübid on esitatud perioodilisustabelis, mille süsteem on aastal loonud vene keemiku Dmitri Mendelejevi (1834-1907) loodud klassifikatsiooni 1869. Keemilised elemendid on visuaalselt järjestatud nende omaduste ja omaduste alusel.
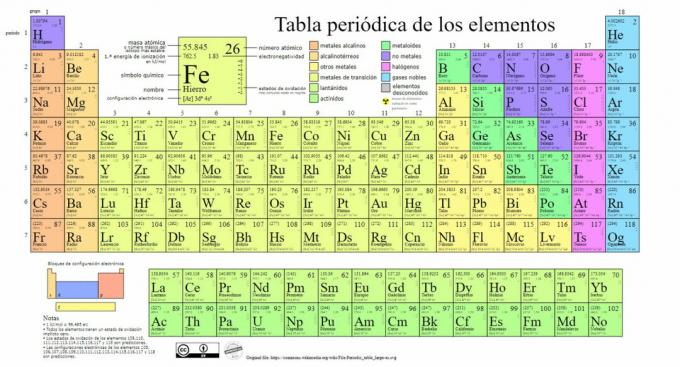
Aja jooksul ja kuna keemia tegi olulisi teaduslikke avastusi, laiendati seda tabelit järjest, jõudes täna teadaolevasse vormi seni tuntud 118 elemendiga.
Praegu leiame sellest tabelist järgmist tüüpi keemilisi elemente:
1. Metallid
Metallid on keemilised elemendid, mis sisaldavad tavaliselt aatomi viimasel orbiidil ühte kuni kolme elektroni, elektrone, mida on lihtne üle kanda muutes need soojus- ja elektrijuhtideks.
Metallid on tavaliselt tempermalmist ja elastsed, iseloomuliku säraga, mille intensiivsus sõltub nende aatomite moodustavate elektronide liikumisest. Enamasti on metallid toatemperatuuril tahked, välja arvatud elavhõbe.
Metallide hulgast leiame kulda (Au), hõbedat (Ag), vaske (Cu) ja alumiiniumi (Al), mille füüsikalised omadused muudavad need suurepärasteks elektrijuhtideks, kuigi nende esinemine looduses on väga mitmekesine, kajastub nende kaalude erinevuses.
Arvatakse, et 75% looduses leiduvatest keemilistest elementidest on metallid, ülejäänud 25% moodustavad väärisgaasid, metalloidid ja muud liigid.
Sellesse kategooriasse on klassifitseeritud aktiniidid, lantaanid, siirdemetallid, leelismetallid, leelismuldmetallid ja muud metallid.
- Seotud artikkel: "10 tsingi sisaldavat toitu"
1.1. Lantaanid
Lantaniidielemente leidub paljudest mineraalidest koosnevates ladestustes. Need on valged metallid, mis õhuga kokkupuutel kergesti oksüdeeruvad. Nende hulgas leiame lantaani (La), prometiumi (Pm), europiumi (Eu) ja ytterbiumi (Yb).

- Teid võib huvitada: "5 tüüpi keemilisi sidemeid: see on aine koostis"
1.2. Aktiniidid
Kõik aktiniidide isotoobid on radioaktiivsed. Nende hulgas leiame aktiniumi (Ac), uraani (U), plutooniumi (Pu) ja einsteiniumi (Es).
1.3. Siirdemetallid
Siirdemetallid asuvad perioodilise süsteemi keskosas. Selle peamine omadus on see d -orbitaali elektrooniline konfiguratsioon on osaliselt elektronidega täidetud.
Sellesse rühma kuuluvad igasugused ained ja selle kõige laiema klassifikatsiooni kohaselt vastaks see keemilistele elementidele vahemikus 21–30, 39–48, 71 kuni 80 ja 103 kuni 112, kokku nelikümmend ja nende hulgas leiame vanaadiumi (V), ruteeniumi (Ru), hõbedat (Ag), tantaali (Ta) ja lawrencio (Lr).

1.4. Leelismetallid
Leelismetallid on rühm kuuest elemendist, mis koosnevad liitiumist (Li), naatriumist (Na), kaaliumist (K), rubiidiumist (Rb), tseesiumist (Cs) ja frantsiumist (Fr). Need on läikivad, pehmed metallid, normaalsel temperatuuril ja rõhul väga reaktiivsed ning kaotavad kergesti oma välise elektroni, mis asub nende orbiidil.
1.5. Leelismuld
Leelismuldmetallid on elementide rühm, milles leiame berülliumi (Be), magneesiumi (Mg), kaltsiumi (Ca), strontsiumi (Sr), baariumi (Ba) ja raadiumi (Ra). Selle nimi tuleneb selle oksiidide, "muldade" nimest, millel on aluselised või leeliselised omadused.
Leelismuld need on leelisest kõvemad, säravad ja on head elektrijuhid. Nad on vähem reaktiivsed kui leeliselised ja toimivad heade redutseerijatena. Neil on võime moodustada ioonseid ühendeid ja nende kõigi väliskesta kaks elektroni.

1.6. Muud metallid
Kategooria "muud metallid" on teatud tüüpi aineid, mida siit leitakse, sest te ei tea tegelikult, kuhu neid panna.
Need on metallist elemendid, mis paiknevad perioodilisustabelis koos metalloididega p -ploki sees. Need kipuvad olema pehmed ja madalate sulamistemperatuuridega. Nende hulgas on alumiinium (Al), indium (In), tina (Sn) ja vismut (Bi).

2. Ei mingeid metalle
Mittemetallidel on viimasel orbiidil tavaliselt viis kuni seitse elektroni, mis on omadus et nad saavad elektronid, selle asemel, et neist loobuda, ja seega õnnestub neil saada kaheksa elektroni, mis stabiliseerivad neid aatomid.
Need elemendid nad on väga halvad soojus- ja elektrijuhid. Lisaks sellele ei ole neil iseloomulikku sära, nad ei ole väga tempermalmist, mitte väga elastsed ja on tahkes olekus väga habras. Erinevalt metallidest ei saa neid rullida ega venitada.
Need on enamasti bioloogiliste süsteemide jaoks hädavajalikud, kuna neid leidub orgaanilised ühendid, nagu väävel (S), süsinik (C), hapnik (O), vesinik (H) ja jood (I).

- Seotud artikkel: "20 tüüpi vääriskive (kirjeldatud ja piltidega)"
3. Metalloidid
Nagu nende nimigi ütleb, on metalloidid vaheklass metallide ja mittemetallide vahel, millel on mõlema rühma omadused. See on tingitud asjaolust, et nende viimasel orbiidil on neli aatomit, mis on metallide ja mittemetallide vaheline kogus.
Need keemilised elemendid juhivad elektrit ainult ühes suunas, mitte lubades seda teha vastupidises suunas nagu metallide puhul. Selle näiteks on meil räni (Si) - metalloid, mida kasutatakse tänu sellele omadusele elektroonikatööstuse pooljuhtide valmistamiseks.
Teised metalloidid on: boor (B), arseen (As), antimon (Sb) ja poloonium (Po).

4. Halogeenid
Halogeenid on rühm kuuest elemendist, mis nad kipuvad moodustama molekule, mis koosnevad kahest aatomist (kaheaatomilised), mis on nende elektronegatiivsuse tõttu väga keemiliselt aktiivsed.
Need ained esinevad tavaliselt ioonide kujul, see tähendab elektriliselt laetud molekulidena, mis antud juhul on mononegatiivsed, tugevalt oksüdeerivad. See tähendab, et halogeenid on söövitavad ja söövitavad ained.
Halogeenid on: fluor (F), kloor (Cl), broom (Br), jood (I), astate (At) ja tenese (Ts).

5. Väärisgaasid
Väärisgaasid on seitsmeliikmeline rühm, mille looduslik olek on gaasiline. Tavaliselt esinevad need kaheaatomiliste molekulidena, millel on väga madal reaktsioonivõime, st nad ei reageeri teiste ainete moodustavate elementidega ja samal põhjusel tuntakse neid inertgaasidena. Seda seetõttu, et selle viimasel orbiidil on sellel tasemel maksimaalne võimalik elektronide arv, kokku kaheksa.
See valitud elementide rühm koosneb heeliumist (He), neoonist (Ne), argoonist (Ar), krüptoonist (Kr), ksenoonist (Xe), radoonist (Rn) ja oganesoonist (Og), mida varem nimetati ununoktiumiks.
