Ero endotermisten reaktioiden ja eksotermisten reaktioiden välillä
A endoterminen reaktio vaatii virtaa, kun a eksoterminen reaktio vapauttaa energiaa. Tässä kemiallisten reaktioiden luokittelussa otetaan huomioon energian osallistuminen joko reagenssina tai tuotteena.
Energia on kyky tehdä työtä tai tuottaa lämpöä. Muista, että kemialliset reaktiot sisältävät atomien uudelleenjärjestymistä aineiden välillä rikkoutuessaan tai muodostuessaan kemiallisia sidoksia. Yleensä tähän kemiallisten sidosten muodostumiseen tai rikkoutumiseen liittyy muutoksia järjestelmän energiassa.
| Endoterminen reaktio | Eksoterminen reaktio | |
|---|---|---|
| Määritelmä | Kemiallinen reaktio, jossa energia absorboituu. | Kemiallinen reaktio, jossa energia vapautuu lämmön muodossa. |
| Energian alkuperä | Ympäristöstä | Järjestelmästä |
| Mahdollinen energia | Reagensseja vähemmän kuin tuotteissa. | Enemmän reagensseja kuin tuotteissa. |
| Tuotanto | Ei spontaani | Spontaani |
| Sisäinen energiamuutos | AE> 0; sisäinen energiamuutos on suurempi kuin nolla. | AE <0; sisäinen energiamuutos on alle nolla. |
| Lämpötila | Vähenee | Kasvaa |
| Esimerkkejä | Reaktiot fotosynteesissä ja synteesissä yleensä. | Palava ottelu, palamisreaktiot. |
Mikä on endoterminen reaktio?
Kemiallinen reaktio on endoterminen, kun imee energiaa ympäristöstä. Tällöin lämpö siirtyy järjestelmän ulkopuolelta sisäpuolelle. Kun asetamme lämpömittarin endotermisen reaktion aikana, lämpötila laskee.
Sana "endoterminen" on peräisin kreikan kielestä endon mikä tarkoittaa "sisällä" ja lämpö mikä tarkoittaa "lämpöä". Endotermiset reaktiot eivät edene spontaanisti.
Mistä energia tulee endotermisissä reaktioissa?
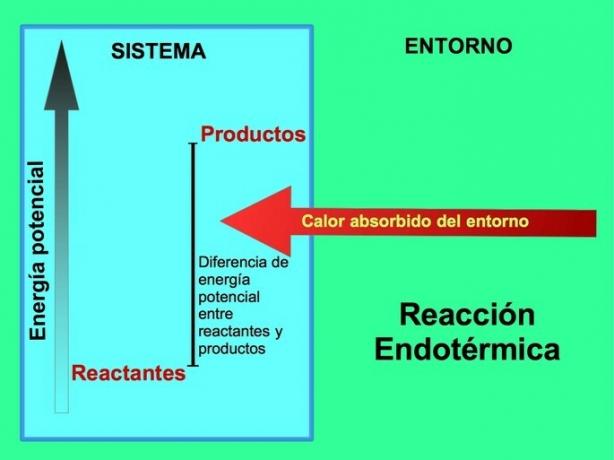
Endotermisissä reaktioissa energia tulee järjestelmän ulkopuolisesta ympäristöstä. Tuotteiden potentiaalisen energian määrä on suurempi kuin reagenssien potentiaalinen energia. Siksi reaktantteihin on lisättävä energiaa, jotta reaktio etenee. Tämä energia tulee ympäristön lämmöstä.
Esimerkiksi, fotosynteesi on endoterminen prosessi, jossa kasvit sieppaavat aurinkoenergiaa tuottamaan glukoosia hiilidioksidista ja hapesta:

Fotosynteesireaktion tuotteilla, glukoosilla ja hapella, on suurempi potentiaalienergian määrä reagoiviin aineisiin, hiilidioksidiin ja veteen nähden. Muita esimerkkejä endotermisistä kemiallisista reaktioista käytetyn energiamäärän kanssa:

Esimerkkejä endotermisestä reaktiosta
Reaktioita ei tapahdu vain kemian laboratoriossa. Päivittäin löydämme myös tilanteita, joissa esiintyy endotermisiä reaktioita.
Valmistaa ruokaa
Vaikka se ei ehkä näytä siltä, ruoanvalmistusprosessi on endoterminen. Jotta voimme kuluttaa tiettyjä ruokia, meidän on tuotettava lämpöä.
Välitön kylmälaukku
Kuoppien tai nyrjähdysten hoitoon käytettävät kylmäpakkaukset täytetään vedellä, mutta ravistamalla tai kolhiessaan kapseli, joka sisältää ammoniumnitraattia, rikkoutuu sisälle. Ammoniumnitraatin sekoittaminen veden kanssa on endoterminen reaktio, joka saa pussin jäähtymään.
Saatat olla kiinnostunut näkemään Lämmön ja lämpötilan ero.
Mikä on eksoterminen reaktio?
A eksoterminen reaktio on sellainen, jossa energia virtaa ulos järjestelmästä. Tämä energia vapautuu lämmön muodossa, joten lämpömittarin sijoittaminen reaktiojärjestelmään nostaa lämpötilaa.
Sana "eksoterminen" muodostuu exo mikä tarkoittaa "ulospäin" ja termit, mikä tarkoittaa "lämpöä". Eksotermisiä reaktioita voi esiintyä spontaanisti ja joissakin tapauksissa ne voivat olla räjähtäviä, kuten alkalimetallien ja veden yhdistelmä.
Mistä energia tulee eksotermisissä reaktioissa?
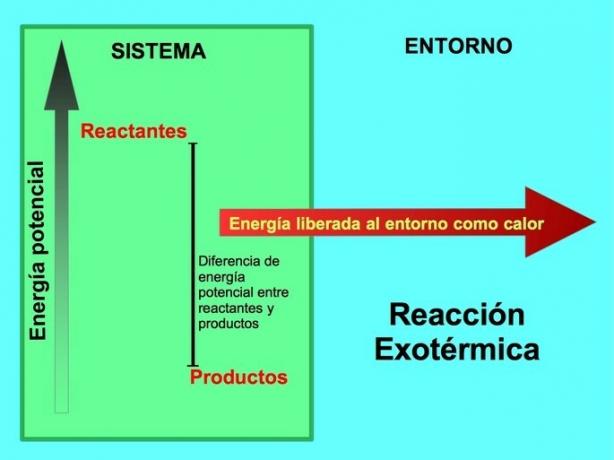
Kemiallisessa reaktiossa reagenssit ovat yhdisteitä, jotka muuttuvat ja tuottavat tuotteita. Esimerkiksi kun natrium Na reagoi kloori Cl: n kanssa, nämä ovat reagoivia aineita ja tuote on natriumkloridi NaCl:

Sekä reagoivat aineet että tuotteet ovat varanneet potentiaalista energiaa. Tiedämme l: stäenergiansäästö ey että energiaa ei menetetä eikä saada, joten reagenssien energian on oltava yhtä suuri kuin tuotteiden energian.
Eksotermisessä reaktiossa lreagensseilla on enemmän potentiaalista energiaa kuin tuotteisiin, joten ylimääräinen energia vapautuu lämpönä. Tässä tapauksessa energiaa pidetään myös osana tuotteita:

Missä tahansa eksotermisessä prosessissa osa kemiallisiin sidoksiin varastoituneesta potentiaalisesta energiasta muuttuu lämpöenergiaksi lämmön avulla.
Esimerkkejä eksotermisestä reaktiosta
Pyykinpesuaine
Kun liuotamme pienen jauhepesuaineen veteen käsissämme, tunnemme lievän kuumenemisen.
Kotitalouksien kaasupoltto
Kotitalouskäyttöön tarkoitettujen kaasujen, kuten metaanin tai butaanin, palaminen sisältää kemiallisen reaktion hapen kanssa, jolloin muodostuu hiilidioksidia ja vettä ja vapautuu energiaa. Tämä on tyypillinen eksoterminen reaktio jokapäiväisessä käytössä:
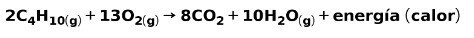
Palamisprosessissa vapautuva energia käytetään ruoan valmistamiseen.
Saatat myös olla kiinnostunut tietämään, mitä he ovat Avoin järjestelmä, suljettu järjestelmä ja eristetty järjestelmä.


