CLASSIFICATION des MÉTAUX du tableau périodique

Les métaux sont les éléments plus abondants dans la table périodique. Ils se caractérisent par: être de bons conducteurs de chaleur et d'électricité, être solides à température ambiante (avec la à l'exception du mercure qui est liquide) et ont la capacité de réfléchir la lumière, ils présentent donc un brillant caractéristique.
Mais ce grand ensemble d'éléments est présenté ordonné dans le tableau périodique en différents groupes ou familles qui reflètent leurs similitudes et leurs différences. Dans cette leçon d'un ENSEIGNANT, nous verrons ce que classement des métaux et quelles sont les caractéristiques et propriétés des différents groupes définis dans cette classification.
Comme nous l'avons déjà mentionné, les métaux sont les éléments majoritaires de la table périodique. Ils sont distribués dans deux super gars qui comprennent, dans chaque cas, divers sous-types regroupés en familles des différents blocs du tableau périodique.
Ci-dessous, nous présentons un bref aperçu de cette classification, que nous développerons plus en détail dans les sections suivantes.
- 1. Métaux représentatifs: bloc s du tableau périodique.
- 1.1. Famille de métaux alcalins
- 1.2. Famille de métaux alcalino-terreux
- 2. Métaux de transition: bloc d du tableau périodique.
- 3. Métaux de transition internes: bloc f du tableau périodique.
- 3.1. Lanthanides: éléments de la 6ème période du tableau.
- 3.2. Actinides: éléments de la période 7 du tableau.
- 4. Métaux post-transitionnels: p bloc du tableau périodique.
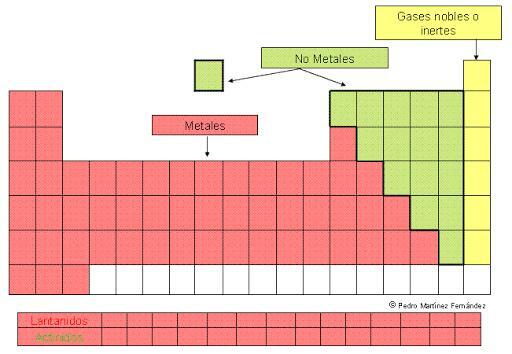
Image: Éducamix
Les éléments représentatifs ou éléments principaux sont les éléments qui sont plus abondante dans la nature. Parmi les éléments métalliques, les éléments représentatifs sont les métaux de la bloc m, c'est-à-dire les éléments alcalins (famille 1 du tableau périodique) et les éléments alcalino-terreux (famille 2 du tableau périodique).
Dans ces deux groupes, nous trouvons des éléments très réactifs, avec une forte tendance à s'oxyder (perdre leurs électrons de la couche de valence) et par conséquent, ce sont de puissants réducteurs d'autres éléments. Dans la nature on les trouve sous forme de sels ioniques très solubles dans l'eau, d'oxydes ou d'hydroxydes (bases fortes).
Métaux alcalins (groupe 1 du tableau périodique)
- Les métaux alcalins représentent 5% de la croûte terrestre. Sodium (Na) et Potassium (K) ils sont les plus abondants.
- Ils sont éléments brillants aspect argenté, faible densité, métaux mous et très réactif. En raison de leur grande réactivité, ils ne se trouvent pas à l'état pur dans la nature. Les points d'ébullition ou d'évaporation des métaux alcalins sont relativement bas et ce sont de bons conducteurs de chaleur et d'électricité.
- Du point de vue de leur configuration électronique, ce sont des éléments qui présentent un électron unique occupant l'orbitale s de sa couche de valence. Ils ont un pouvoir de combinaison de 1 (valence) et un nombre d'oxydation +1. Ils montrent une grande tendance à perdre l'électron de l'enveloppe la plus externe pour former des cations.
- En tant que bioéléments, les métaux alcalins développent une rôle important dans les organismes vivants, notamment le sodium et le potassium, qui jouent un rôle fondamental dans la transmission nerveuse et, dans le cas du potassium, dans la régulation de l'activité enzymatique.
- Ces métaux ont usages multiples dans l'industrie. Par exemple, le lithium (Li) est utilisé pour produire des alliages d'aluminium à haute résistance, dans la production de céramique ou comme composants de batterie. Il a également des usages médicaux puisqu'il constitue un composant du système nerveux et que sa carence provoque des maladies psychiatriques.
Noter: Le groupe 1 du tableau périodique comprend également l'hydrogène, qui n'est pas un métal.
Métaux alcalino-terreux (groupe 2 du tableau périodique):
- Les métaux alcalino-terreux représentent 4% de la composition de la croûte terrestre. Ils sont particulièrement abondants calcium (Ca) et magnésium (Mg).
- Comme les métaux alcalins, ces métaux ils sont très réactifs par conséquent, ils ne se trouvent pas sous forme libre dans la nature.
- Bien qu'ils aient des caractéristiques physico-chimiques similaires à celles des métaux alcalins, ils ont tendance à être plus durs et moins réactifs que les métaux alcalins. Ils ont de faibles densités et des duretés et des points de fusion supérieurs à ceux des métaux alcalins.
- Du point de vue de la configuration électronique, ils sont caractérisés par présenter l'orbitale s de la couche de valence remplie (c'est-à-dire occupé par une paire d'électrons). Par conséquent, ils ont un pouvoir de combinaison de 2 (valence) et un nombre d'oxydation de +2. Ils réagissent facilement avec les halogènes (groupe 17 du tableau périodique), pour former des sels ioniques.
- Votre rôle en tant que constituants des organismes vivants il est particulièrement important dans le cas du calcium (Ca) et du magnésium (Mg). Les ions magnésium et calcium sont les ions les plus abondants dans l'eau de mer avec l'ion chlorure (Cl-).
- 99% du calcium de notre corps se trouve dans le squelette, mais sous sa forme ionique a un rôle fondamental dans la transmission nerveuse, la fonction neuromusculaire et la régulation enzymatique.
- Le magnésium, sous sa forme ionique, remplit des fonctions biologiques importantes dans les organismes vivants, notamment le plus important, son rôle fondamental dans la photosynthèse des plantes en tant que composant de la chlorophylle.
- Les utilisations industrielles des métaux alcalino-terreux sont diverses. Les plus pertinents sont l'utilisation du calcium comme composant du ciment, l'utilisation du magnésium pour l'élaboration des feux artificiel, en tant que revêtement de structures en fer pour empêcher leur oxydation ou en tant que composant d'alliages et d'aciers lumière.
Image: Google Sites
Dans la classification des métaux, nous devons parler de métaux de transition ou de métaux de la bloc d, sont le groupe de métaux le plus abondant et sont regroupés dans un total de 10 groupes ou familles du tableau périodique.
- La plupart des métaux de transition ont des caractéristiques similaires aux métaux représentatifs: ils sont bons conducteurs de chaleur et d'électricité et réfléchissent la lumière.
- Ils présentent une grande variabilité en termes de dureté et de points d'ébullition et de fusion mais, en général, ils sont plus dur et ont des points de fusion et d'ébullition plus élevés que les métaux alcalins et alcalino-terreux.
- Depuis le point de vue chimique ils sont caractérisés par: ayant plusieurs nombres de coordination (valences) ou états d'oxydation, ils sont généralement de bons catalyseurs (capacité d'augmenter ou de diminuer la vitesse des réactions chimiques) et former des composés colorés et avoir la capacité de forment des complexes de coordination (composés chimiques avec un ion métallique au centre, attachés à une série de ligands disposés à leur environ). Pour cette raison, les métaux de transition forment des cations de charges différentes.
- La densité est très variable dans ce bloc d'éléments, du strontium de faible densité à l'osmium (Os), qui est l'élément de densité la plus élevée du tableau périodique.
- Si nous regardons la configuration électronique des métaux de transition, ils se caractérisent par la présentation orbitales d partiellement remplies. Le remplissage des orbitales dans ce bloc du tableau périodique présente une série d'irrégularités, qui se reflètent dans les multiples nombres d'oxydation acquis par les métaux dans ce bloc du tableau périodique.
Fer (Fe) et titane (Ti): métaux de transition plus abondants
- Le fer est le plus abondant et représente environ 5% du poids de la croûte terrestre. Il est rare de le trouver sous sa forme élémentaire dans la nature, où il se trouve normalement pour former des oxydes et des carbonates.
- Le fer pur a peu d'utilisations, mais ses alliages avec d'autres substances ont de multiples usages. Les formes utiles d'alliages de fer sont le fer forgé (c'est un alliage de fer qui se caractérise par sa faible teneur en carbone et sa teneur élevée en fer. Il a la propriété de pouvoir être moulé à chaud et durcit lors d'un refroidissement rapide), de la fonte (également connue sous le nom de nom de fonte grise ou fonte, c'est un alliage de fer, de silicium et de carbone qui contient de petites quantités de manganèse, de phosphore et soufre; dans lequel le carbone est sous forme de graphite) et l'acier (un alliage purifié de fer et de carbone).
- D'autres métaux de transition largement utilisés dans l'industrie sont cuivre et argent. De plus, de nombreux métaux de transition sont utilisés dans l'industrie comme catalyseurs de réactions chimiques.
- Au niveau biologique, le fer sous sa forme ionique a un rôle fondamental dans la transport d'oxygène, puisqu'il fait partie du centre actif de l'hémoglobine et de la myoglobine.
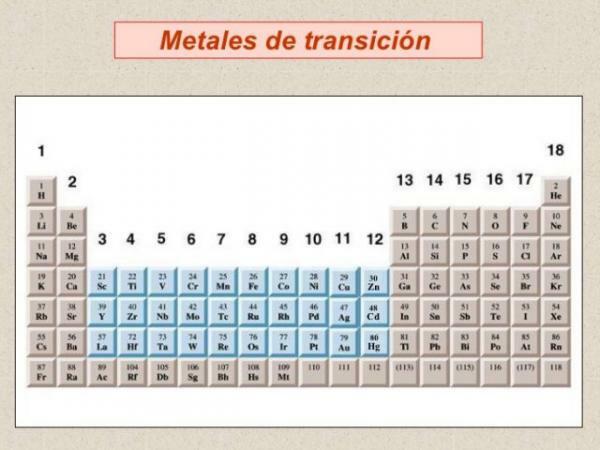
Image: site 100cia
Les métaux de transition internes ou les métaux de la bloc fOn les appelle aussi terres rares. Ils sont regroupés en deux familles d'éléments: lanthanides et les actinides. Ce sont ces éléments métalliques dans lesquels se trouvent des électrons occupant les orbitales f. Les éléments du groupe des lanthanides ont occupé en partie les orbitales f de niveau 4 et les actinides celles de niveau 5.
Lanthanides ou lanthanoïdes
- Ce sont les 15 éléments de la transition interne qui font partie du période 6 du tableau périodique des éléments.
- Ce groupe d'éléments a des propriétés caractéristiques communes. Il s'agit de métaux mous et brillants d'argent, Sa conductivité de la chaleur et de l'électricité est relativement faible par rapport à d'autres métaux. Ce sont des métaux de plus faible densité que les métaux de transition.
- Dans la nature, on les trouve en faibles proportions, faisant partie de nombreux minéraux. Les lanthanides ont une grande capacité d'aimantation ou d'aimantation et se caractérisent également par la luminescence de leurs cations.
- Les lanthanides ont usages multiples dans l'industrie dans la production d'aimants permanents puissants, de batteries rechargeables et la fabrication de matériaux supraconducteurs. Ils ont de multiples applications en optique (fabrication de tubes et lampes fluorescentes, afficheurs à cristaux liquides et lasers). Ils sont également utilisés comme catalyseurs de réactions chimiques ou comme pigments.
Actinides ou actinoïdes
- Ce sont les 15 éléments qui composent le période 7 du tableau périodique.
- Beaucoup d'entre eux ont été synthétisés artificiellement, mais ils se trouvent également dans la nature en très faibles proportions.
- Ils présentent un comportement similaire à celui des métaux de transition (bloc d) et différent de celui des lanthanides. Comme dans le cas de nombreux métaux, ils ont un éclat argenté caractéristique.
- En tant que groupe, leur importance réside dans le fait qu'ils sont tous éléments radioactifs. C'est-à-dire que ce sont des éléments dont les noyaux sont instables se désintègrent, libèrent de l'énergie (énergie nucléaire) et donnent naissance à d'autres éléments chimiques avec un noyau plus stable. Tous les isotopes des éléments de ce groupe sont radioactifs et ont une courte demi-vie. Les actinides les plus abondants dans la nature sont l'uranium (U) et le thorium (Th).
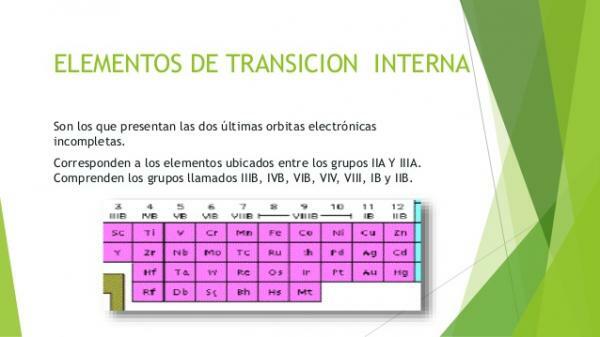
Image: partage de diapositives

