Parties d'un atome et leurs caractéristiques
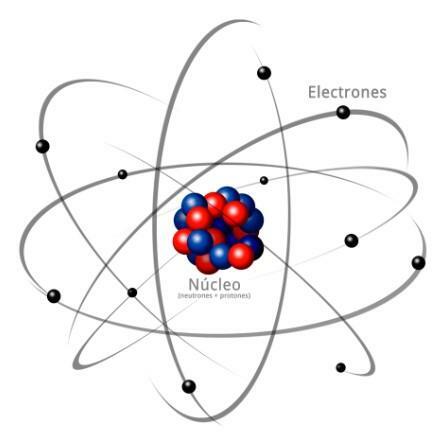
Image: Réponses.conseils
Les atomes sont les éléments de base qui matière de forme, présent dans tous les états de la matière. Ce sont de très petits éléments, impossibles à voir à travers l'œil humain mais ils sont vraiment importants pour notre univers. Pour mieux comprendre comment sont les atomes et comment ils fonctionnent, dans cette leçon d'un PROFESSEUR nous allons parler de parties d'un atome et leurs caractéristiques.
Tous les atomes sont constitués d'un noyau et une croûte. Le noyau, comme son nom l'indique, est la partie centrale de l'atome, où se trouvent les particules dont la charge est positive et que l'on appelle protons, et les particules dont la charge est neutre, c'est-à-dire qu'elles n'ont pas de charge électrique, recevant le nom de neutrons. La masse des deux particules, les protons et les neutrons, est similaire. Tous les atomes d'un même élément chimique ont un nombre égal de protons, ce chiffre étant appelé le numéro atomique et la lettre Z étant utilisée pour le représenter.
D'autre part il y a le Cortex quel est le partie externe de l'atome. Dans l'écorce, nous trouvons le électrons, qui sont des particules chargées négativement. Les électrons tournent à grande vitesse autour du noyau à différents niveaux, étant des particules beaucoup plus petites que celles qui se trouvent dans le noyau.
Étant des neutrons neutres, des protons positifs et des électrons négatifs, l'atome a une charge électrique neutre, car ils ont le même nombre de protons que d'électrons. Bien qu'il existe des cas dans lesquels les électrons sont en nombre inférieur ou supérieur à celui des protons, provoquant la charge l'atome est négatif ou positif, dans ce cas il reçoit le nom d'ion, d'anion s'il est négatif ou de cation s'il est positif.
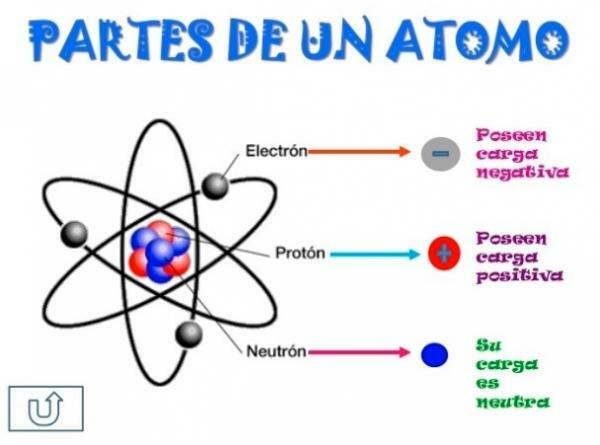
Image: Intellectuellement
Pour continuer cette leçon sur les parties d'un atome et leurs caractéristiques, nous devons parler de l'évolution qu'ont eu les parties de l'atome, depuis le modèle atomique a changé au fil du temps grâce aux études des scientifiques. Il faut tenir compte du fait que plusieurs des modèles que nous allons expliquer sont obsolètes, n'étant pas utilisés à l'heure actuelle, mais ils sont nécessaires pour comprendre l'évolution de la communauté scientifique sur ce sujet.
L'évolution historique du modèle atomique est caractérisée par les scientifiques suivants:
- Modèle Dalton : Le premier modèle atomique fut l'œuvre de John Dalton en 1803. C'est un modèle très primitif auquel il manque de nombreux éléments comme la présence d'électrons et de protons.
- Modèle Thomson : John Thomson a réussi à créer un modèle atomique plus complet que celui de Dalton, en ajoutant plusieurs éléments clés. Thomson a découvert l'existence d'électrons et de charges positives et négatives.
- Modèle Nagaoka : Le physicien japonais Nagaoka n'était pas d'accord avec le modèle de Thomson, il pensait que l'atome devait avoir un gros noyau chargé positivement sur lequel tournent des électrons chargés négativement. Sa théorie est dite saturnienne, car il compare les électrons aux anneaux de Saturne. Souvent, ce modèle n'est pas nommé, mais il est essentiel de comprendre le grand pas qui est fait en ce moment.
- Modèle Rutherford : Le modèle de Rutherford était basé sur l'existence d'un noyau chargé positivement sur lequel tournaient des électrons chargés négativement. Ce modèle est très similaire à celui de Nagaoka, étant d'années très proches, bien que le modèle japonais soit antérieur.
- Modèle Bohr : Bohr pensait que les électrons devaient être éloignés du noyau stratifié et que le nombre de ces particules orbitales devait être égal au numéro atomique. Son modèle comprend également que le nombre d'électrons varie dans chaque couche, avec moins d'électrons dans la première couche que dans la dernière.
- Modèle Schrödinger : Schrödinger a brisé la croyance que les électrons sont de minuscules particules qui tournent autour du noyau. Le scientifique autrichien a soutenu que les électrons se déplaçaient au moyen d'une fonction d'onde, c'est-à-dire par forme orbitale.
- Modèle Dirac : Dirac a modifié les idées de Schrödinger pour son modèle, en utilisant "l'équation de Dirac" pour donner une vue plus correcte de la forme orbitale des électrons.

