Découvrez comment la TABLE PERIODIQUE est organisée de manière FACILE et PRATIQUE

Image: ptable.com
En 1869, le chimiste russe Dimitri Ivanovich Mendeleev a mis au point un moyen de classer tous les éléments chimiques qui apparaissent dans la nature. Cette méthode de classification est le tableau périodique et beaucoup le décrivent comme le « cœur de la chimie ». Le tableau périodique est né avec seulement 63 éléments chimiques, mais au fur et à mesure de leur découverte, de nombreux éléments chimiques ont été ajoutés à ses rangs.
Dans cette leçon d'un ENSEIGNANT, nous passerons en revue comment le tableau périodique est organisé, en voyant quels critères sont suivis pour mettre les différents éléments dans les cases de ce tableau.
À colonnes du tableau périodique ils ont été appelés groupes. Actuellement, dans le tableau périodique normalement utilisé, c'est-à-dire le tableau standard, il y a 18 groupes, numérotés de gauche à droite de 1 à 18. Cette façon de nommer les groupes (nomenclature) peut varier: parfois une nomenclature mixte de chiffres romains et de lettres est utilisée, d'autres fois les groupes ont des noms communs (métaux alcalis, halogènes, gaz rares, etc.) et dans d'autres, ils sont nommés comme "le groupe de ..." et le nom de son premier membre (par exemple, "le groupe de scandium" pour le groupe 3).
Les éléments d'un même groupe peuvent avoir modèles de propriétés différentes:
- Augmentation du rayon atomique, de haut en bas dans un groupe. Au fur et à mesure que nous descendons dans le tableau périodique, le nombre d'électrons augmente et donc le nombre de coquilles qui en sont remplies. Par conséquent, les électrons de la dernière couche (couche de valence) sont de plus en plus éloignés du noyau et les atomes deviennent de plus en plus gros, c'est-à-dire qu'ils ont un rayon plus grand.
- Du haut, chaque élément a un moins d'énergie d'ionisation. Comme il y a plus d'électrons, ceux trouvés dans la couche de valence sont plus éloignés du noyau et donc Cela les attire avec moins de force, ce qui facilite l'élimination des électrons au fur et à mesure que nous descendons la table. périodique.
- Enfin, on observe également une diminution de l'électronégativité au sein d'un même groupe. Encore une fois, à mesure que la distance entre les électrons de valence et le noyau augmente, les électrons des autres atomes sont plus loin de la force d'attraction du noyau et donc il les attire avec moins de force que les atomes plus petits (groupes plus haute).
Ces régularités sont des tendances, c'est-à-dire qu'il y a certaines exceptions comme ce qui se passe dans le groupe 11, où l'électronégativité augmente plus loin dans le groupe. De plus, dans certaines parties du tableau périodique telles que les blocs d et f, les similitudes horizontales entre les éléments du même groupe ne sont pas aussi marquées.

Image: Bibliothèque de recherche
Les sept rangées horizontales du tableau périodique sont appelées périodes. Le nombre de niveaux d'énergie d'un atome détermine la période à laquelle il appartient. Chaque niveau est divisé en différentes catégories appelées coquilles ou orbitales électroniques qui peuvent être de type s, p, d et f.
Comme ce qui s'est passé dans les groupes, les articles de la même période ont des motifs similaires rayon atomique, énergie d'ionisation, affinité électronique et électronégativité :
- Dans une période, le rayon atomique il descend normalement si nous nous déplaçons vers la droite sur le tableau périodique. Au fur et à mesure que nous passons d'un élément à l'autre, des protons et des électrons s'ajoutent, les faisant les électrons sont attirés dans le noyau (rappelez-vous que les électrons sont trop légers pour la force d'attraction cœur).
- La diminution du rayon atomique au cours de la même période rend le énergie d'ionisation et électronégativité augmente de gauche à droite, puisque l'attraction que le noyau exerce sur les électrons augmente.
- La Affinité électronique il montre également une tendance au cours de la période, quoique plus douce. Les métaux, qui sont à gauche du tableau périodique, ont généralement une affinité plus faible que les non-métaux, qui sont à droite de la période. Ceci est une généralité et n'est pas vrai pour les gaz rares, qui ont leur dernière couche (couche de valence) remplie et sont donc très peu réactifs.
Image: SlidePlayer
Les éléments du tableau périodique peuvent être divisés en blocs selon l'ordre dans lequel les couches électroniques des éléments sont complétées. Chaque bloc est nommé selon le dernierorbitale dans laquelle, en théorie, est le dernier électron (s, p, d ou f):
- Le bloc s Il est composé des deux premiers groupes, l'hydrogène et l'hélium.
- Le bloc p Il est composé des six derniers groupes (groupes 13 à 18).
- Bloc d Il est composé des groupes 3 à 12 (communément appelés métaux de transition).
- Le bloc f, qui est normalement placé séparément, sous le reste du tableau périodique, n'a pas de numéro de groupe et est composé de lanthanides et d'actinides.
Le tableau périodique des éléments a survécu pendant tant d'années car c'est un système qui s'est avéré très utile et surtout parce qu'il peut être mis à jour. En théorie, il pourrait y avoir plus d'éléments qui rempliraient d'autres orbitales, mais ceux-ci n'ont pas encore été synthétisés ou n'ont pas été découverts. Dans le cas où de nouveaux éléments atomiques seraient découverts, les chercheurs continueraient par ordre alphabétique pour nommer les différents blocs (bloc g, bloc h, etc.).
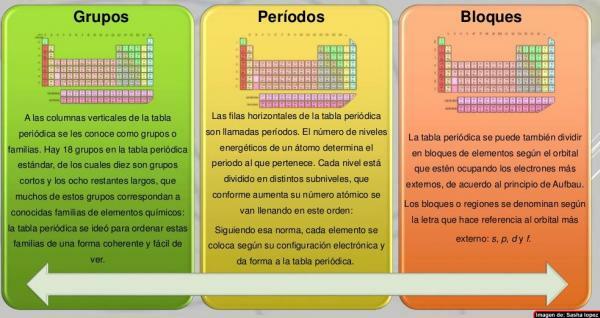
Image: Educando, le portail de l'éducation dominicaine

