Structure et caractéristiques de l'atome

Image: SlidePlayer
Les atomes font partie de notre monde. Toute matière est constituée d'atomes, il est donc important de mieux comprendre en quoi ils consistent et quelles sont leurs fonctions. Dans cette leçon d'un ENSEIGNANT, nous allons vous dire ce que structure d'un atome et caractéristiques. Si vous voulez en savoir plus sur les particules qui composent toute matière, continuez à lire cet article.
Indice
- Que sont les atomes ?
- Structure de l'atome
- Principales caractéristiques de l'atome
- Que sont les isotopes ?
- Comment se trouvent les atomes dans la nature ?
Que sont les atomes?
le atome c'est la plus petite unité en laquelle la matière peut être divisée sans perdre ses propriétés chimiques, c'est-à-dire ses propriétés en tant qu'élément chimique. L'atome est à l'origine de tout ce qui peut être vu ou touché, des étoiles à votre petit-déjeuner ce matin.
Si l'on met de côté la perte de ses propriétés chimiques, on peut dire que l'atome est composé de différentes particules, appelées particules subatomiques. Il existe trois types de particules subatomiques
-protons, neutrons et électrons- avec des caractéristiques différentes.Ces particules sont regroupées en nombres différents pour former les éléments chimiques (oxygène, carbone, etc.), mais elles seront toujours réparties suivant une structure fixe.

Image: Google Sites
Structure de l'atome.
La structure de l'atome est fixe, c'est-à-dire que nous pouvons avoir différents types d'atomes (l'atome d'hydrogène, l'atome d'oxygène, etc.) mais leurs particules subatomiques sont toujours organisées de la même manière qu'un système planétaire.
Vous vous souviendrez sûrement de l'organisation du système solaire: le Soleil est au centre et autour à partir de là, les planètes tournent en décrivant des orbites différentes, certaines plus proches et d'autres plus éloignées de la Soleil. Dans le cas des atomes, au centre se trouve le cœur, avec une forme semblable à une mûre et est composé de la neutrons et les protons.
Autour du noyau se trouve le Cortex qui est la zone à travers laquelle le électrons. Autrefois, on pensait que les électrons décrivaient certaines orbites, comme le font les planètes, bien qu'il soit maintenant sait que ces orbites ne sont pas si bien définies et ressemblent davantage à des zones dans lesquelles nous sommes plus susceptibles de nous trouver électrons.
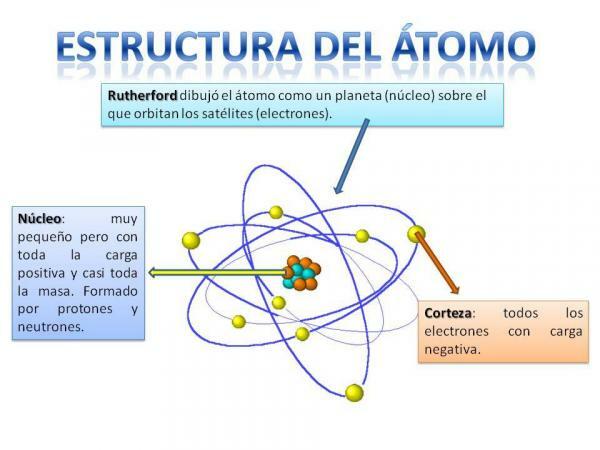
Image: REA - Plan Ceibal
Principales caractéristiques de l'atome.
Pour poursuivre cette leçon sur la structure de l'atome et ses caractéristiques, il est important de se concentrer sur les éléments qui font qu'un atome est considéré comme tel.
Et pour cela, nous devons répondre à cette question: pourquoi tous les atomes décident-ils de s'ordonner de cette manière? La réponse est simple: c'est à cause de forces d'attraction électriques. Le noyau de l'atome est composé de neutrons, qui n'ont pas de charge électrique, et de protons, qui ont une charge électrique positive. et les électrons ont une charge électrique négative, il y a donc une force d'attraction similaire entre le noyau et les électrons produit entre les deux pôles d'un aimant mais n'est pas assez puissant pour que les électrons « tombent » sur le cœur.
Ceci est mieux compris si l'on tient compte de la taille du noyau: si l'atome avait, par exemple, la dimension d'un stade de football, le noyau aurait la dimension du ballon au centre du terrain Quelle attraction le ballon de football devrait-il produire pour que les gradins du stade tombent dessus !
La fonction des neutrons
Maintenant, vous vous demandez peut-être quel rôle jouent les neutrons? Bien qu'ils n'aient pas de charge électrique, les neutrons jouent un grand rôle dans l'atome: ils contribuent à 99 % de la masse. Si cela vous aide à vous souvenir, on peut dire qu'un atome est comme une bande de trois amis: le lourd neutron, le proton positif et l'électron négatif, qui fait le tour du neutron et électron.
Le mouvement des électrons
À ce stade, je veux que nous revenions à quelque chose que nous avions laissé dans l'encrier: les orbites que les électrons décrivent autour du noyau. Nous avions dit que les électrons tournent autour du noyau Comme le font les planètes autour du Soleil, certaines plus proches que d'autres, pourquoi le font-elles? Les électrons tournent dans une couche ou une autre en fonction de l'énergie dont ils disposent pour s'éloigner du noyau, c'est-à-dire que les électrons les plus proches du noyau n'ont pas la suffisamment de force pour s'éloigner du noyau tandis que ceux des coquilles les plus externes (orbitales) de la croûte ont plus d'énergie et ont pu s'éloigner davantage du noyau. cœur. De plus, dans chacune des orbitales il y a une capacité maximale de 8 électrons (règle de l'octet).
Les particules d'un atome
Nous allons revenir à une autre approche que nous avons faite précédemment mais que nous n'avons pas expliquée: les atomes sont constitués de neutrons, protons et électrons, qui se combinent toujours en suivant la même structure de noyau et de croûte, mais ils le font en nombres différents pour former les différents éléments chimiques. Comment pouvons-nous obtenir autant d'éléments combinant seulement 3 types de particules? Les éléments chimiques, que vous avez déjà vus représentés dans le tableau périodique, se caractérisent par un certain numéro atomique.
le numéro atomique (Z) Il indique le nombre de protons dans le noyau de ce type d'atomes, qui est égal au nombre d'électrons dans des conditions normales. Ainsi, par exemple, tous les atomes qui ont 6 protons (Z = 6) seront des atomes de carbone, et ils auront les mêmes propriétés chimiques; les atomes à 5 protons (Z = 5) seront des atomes de bore, ayant les mêmes propriétés chimiques les uns que les autres et différents de ceux des atomes de carbone. Vous n'avez pas à confondre le numéro atomique avec le poids atomique ou nombre de masse (A), qui est la somme du poids des neutrons et des protons (le poids des électrons est négligeable par rapport au poids du noyau total).

Image: SlidePlayer
Que sont les isotopes?
Dans la nature, nous pouvons trouver différents "sous-types" d'éléments, les isotopes. Je suis sûr qu'à un moment donné vous avez entendu parler du carbone 14, un isotope radioactif du carbone qui est utilisé pour déterminer, entre autres, l'âge des fossiles. Les isotopes sont deux atomes avec le même nombre de protons (même numéro atomique), mais nombre de neutrons différent (masse atomique différente). Les isotopes d'un même élément sont généralement nommés avec le nom de l'élément suivi de sa masse atomique.
Dans notre exemple, les deux isotopes sont du carbone, ils ont donc un numéro atomique de 6 (Z = 6) mais le carbone 12 (carbone « normal ») a un poids atomique de 12 par rapport au poids atomique du carbone 14 14. Les isotopes d'un même élément ont des propriétés chimiques et physiques très similaires. Dans le cas du carbone 14, contrairement au carbone 12, il s'agit d'un isotope radioactif présent dans tous les éléments contenant du carbone, y compris les êtres vivants.
Et avec cela, nous terminons cette leçon sur la structure de l'atome et ses caractéristiques. Nous espérons que cela vous a été utile.

Image: Vos tâches
Comment se trouvent les atomes dans la nature?
Les atomes peuvent être trouvés isolément, mais le plus normal est de les trouver combinés en groupes appelé molécules.
Les molécules peuvent être constituées d'atomes d'un même élément (comme la molécule d'oxygène, constituée de deux atomes de oxygène) ou par des groupes avec des atomes d'éléments différents (deux atomes d'hydrogène et un d'oxygène forment la molécule de L'eau). Ces groupes d'éléments sont appelés molécules, qui à leur tour peuvent être combinés les uns avec les autres et formant des groupements différents de plus en plus complexes selon leur réactivité et leur affinité chimique pour source de liens chimiques.
Si vous voulez lire plus d'articles similaires à Structure et caractéristiques de l'atome, nous vous recommandons d'entrer dans notre catégorie de L'atome.
