Que sont les FORMULES CHIMIQUES et à quoi servent-elles [RÉSUMÉ + VIDÉOS]
Bien qu'il ne semble pas, les éléments chimiques du tableau périodique Ils nous entourent de toutes parts. Cependant, bien souvent, ils ne se trouvent pas séparément, mais forment plutôt des molécules ou des macromolécules de divers éléments chimiques. Les formules chimiques sont l'expression graphique de ces composés et sont utilisées afin de standardiser leur nomenclature. Dans cette leçon d'un ENSEIGNANT, nous verrons que sont les formules chimiques et à quoi servent-elles. Rejoignez-nous pour en savoir plus !
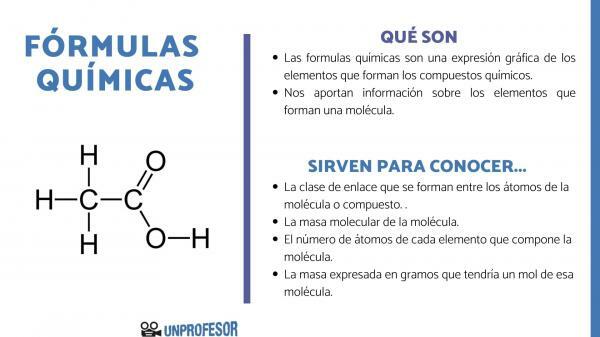
Les formules chimiques sont une expression graphique des éléments qui composent le composants chimiques.
Ces formules chimiques ne sont pas arbitraires, mais suivent certaines règles strictes de la nomenclature chimique, établie par le IUPAC (Union internationale de chimie pure et appliquée).
Les formules chimiques nous fournissent également des informations sur la éléments qui composent une molécule, ainsi, par exemple, il nous indique le nombre et les proportions respectives de chacun des atomes qui le composent et, parfois, même le type de
Liaison chimique qui existe entre ces éléments.Chaque molécule ou macromolécule qui existe correspond à sa formule chimique, cependant il y a différents types de formules. Chacun de ces types nous donne des informations différentes sur la molécule, mais ils nous aident tous à comprendre son nature chimique et cela nous aide à comprendre ce qui se passe dans les réactions chimiques et comment un composé peut se transformer en d'autres.
Mais pour comprendre cette nomenclature chimique, il est nécessaire d'avoir certaines connaissances en chimie, car elles obéissent à un langage technique assez spécialisé.

Image: Lecteur de diapositives
Les formules chimiques sont représentés par le union de symboles chimiques, avec la lettre correspondante de chaque atome tel qu'il vient dans le table périodique, et les indices, qui sont des nombres qui représentent le montant de ces atomes dans la molécule
Dans la chimie (à la fois organique et inorganique), il existe certains fragments ou composés qui présentent une certaine récurrence à la fois structurelle et fonctionnelle et sont identifiés par des noms spécifique. Lorsque ces fragments ont des électrons libres qui ne sont pas partagés, ils sont appelés radicaux et ce sont des composés instables et hautement réactifs avec une courte demi-vie.
Des exemples de radicaux sont groupes méthyle CH3, groupes nitrate NO3, des groupes hydroxyle OH- ou le radical Cl-. Cependant, ils sont appelés groupes fonctionnels lorsqu'il s'agit d'atomes ou de groupes d'atomes attachés à une chaîne dioxyde de carbone (avec divers carbones) et qui sont responsables de la réactivité et des propriétés chimiques des molécules.
Ces groupes sont particulièrement importants en chimie organique (les biomolécules humaines sont essentiellement du carbone et de l'hydrogène). Quelques exemples de groupes fonctionnels sont le groupe carbonyle = C = O ou le groupe carboxyle -COOH.

Image: Monogramas.com
Comme nous l'avons dit, il existe plusieurs types de formules chimiques. Chacune de ces formules nous donne un type différent d'informations sur les molécules et, par conséquent, elle sert un objectif particulier, sans qu'aucune formule ne soit meilleure ou pire qu'une autre en termes généraux.
Les classes de formules chimiques que nous distinguons sont :
Formules empiriques
Les formules empiriques sont les formules les plus simples pour représenter une molécule chimique, disant parfois qu'il s'agit de formules minimales. Ces formules représentent la proportion des atomes de chacun des éléments de la molécule, qui sont simplifiés en nombres entiers, toujours les plus petits. Un exemple de cette formule est CH3 (groupe méthyle), avec trois atomes d'hydrogène et un atome de carbone.
Cependant, ces formules peuvent parfois donner des idées fausses sur la composition de la molécule. Cela se produit lorsque la formule n'indique pas le nombre réel d'atomes dans la molécule, comme avec le peroxyde l'hydrogène, dont la formule empirique est HO alors que la formule devrait être H2O2 (deux atomes d'hydrogène et deux de oxygène). Cela passe donc par une convention de nomenclature, puisque les deux indices sont égaux, ils sont simplifiés.
Certains composés, cependant, ne peuvent être représentés que par des formules empiriques, car ils sont constitués de réseaux d'ions. Cela se produit par exemple dans le sel commun ou le chlorure de sodium, qui est représenté par NaCl, ce qui indique que pour chaque sodium il y a un chlore.
Formules moléculaires
Ces types de formules sont assez basiques, elles expriment simplement le type d'atomes et le nombre de chacun présent dans une molécule covalente. Ce sont des formules qui présentent les éléments chimiques et le nombre de manière linéaire (sous la forme d'un indice. Un exemple de ce type de formule est lorsque le glucose est nommé C6H12O6, qui exprime que le glucose La molécule de glucose est composée de six atomes de carbone, douze atomes d'hydrogène et six de oxygène.
Les formules moléculaires sont largement utilisées, disant parfois qu'elles sont les vraies formules des molécules. Dans de nombreux cas, elles coïncident avec les formules empiriques, par exemple en CO2.
Formules semi-développées
Les formules semi-développées sont un type de formules similaires aux formules moléculaires, car elles expriment également les atomes qui composent la molécule et leur nombre, mais aussi renseigner sur les liaisons chimiques (représentées par des traits entre atomes) et le type de liaison entre les atomes de carbone qui la forment (s'ils sont simples, doubles ou triplé). La formule semi-développée est utile pour identifier les radicaux qui composent la molécule et sa structure chimique (les liaisons entre les atomes de carbone et d'hydrogène ne sont pas représentées).
Dans le cas du glucose, sa formule semi-développée est CH2OH - CHOH - CHOH - CHOH -CHOH - CHO et comme on peut le voir les atomes de carbone, d'hydrogène et l'oxygène sont les mêmes que dans la formule moléculaire (six, douze et six, respectivement) et toutes les liaisons simples (le glucose n'a que des liaisons Facile). Cette formule est donc une formule plus complexe que la formule moléculaire.
Les formules semi-développées sont parfois appelées condensées et sont peut-être la classe de formules la plus largement utilisée. utilisés, notamment en chimie organique, bien qu'ils ne permettent pas d'observer la géométrie réelle des molécules.
Formule développée
Les formules développées sont un peu plus complexes que les formules semi-développées. Dans ce type de formules, la liaison et l'emplacement de chaque atome dans la molécule sont représentés dans un plan cartésien, jusqu'à ce que l'ensemble du composé soit représenté.
Formule structurelle
La formule structurelle est une représentation graphique de la structure de la molécule dans l'espace, nous donnant des informations sur l'ordre et la distribution des atomes dans l'espace. Dans cette formule, les liaisons chimiques qui composent la molécule sont également indiquées et si elles sont simples, doubles ou triples. Cette formule est donc celle qui nous donne le plus d'informations sur la molécule.
Ces types de formules sont plus utilisées à un niveau professionnel dans le monde de la chimie, car elles permettent de voir beaucoup plus clairement les réactions chimiques ou la synthèse de nouvelles molécules.
formules de Lewis
Ce sont des formules complexes, très spécifiques et techniques. Ils sont également connus sous le nom de diagrammes ou de structures de Lewis et sont similaires aux formules développées de molécules, mais De plus, les électrons que les atomes partagent dans chaque liaison chimique sont indiqués, qui varient avec la valence des atomes impliqué.
Dans ces formules, les liaisons entre atomes sont représentées par des lignes (indiquant également si elles sont simples, doubles ou triples) ou par une paire de points. Les électrons solitaires ou non partagés dans la liaison, sont représentés par des points autour de l'atome auquel il correspond.

Image: Chimie organique
Lors de l'écriture des formules, il est parfois fait référence aunombre d'oxydation de l'élément (elle est fréquente dans les composés ioniques). Ce sont un ensemble de nombres positifs et négatifs qui vont associé à chaque élément.
- Les nombres d'oxydation peuvent être interprétés comme nombre d'électrons qu'un élément partage une liaison covalente ou transfère une liaison ionique.
- Lorsque le signe d'oxydation au-dessus de l'atome est négatif, signifie que cet élément capte des électrons et le nombre qui l'accompagne à côté est le nombre d'électrons captés. Par conséquent, un état d'oxydation de -1 signifie que l'élément capte un électron, -2 qui en capte deux, et ainsi de suite.
- Lorsque le signe d'oxydation est positif, l'atome cède un électron et le nombre qui accompagne ce signe est le nombre d'électrons abandonnés. De même, un état d'oxydation de +1 signifie qu'il donne un électron, +2 qu'il en donne deux, et ainsi de suite.
Cela fonctionne principalement pour composés ioniques, dans les liaisons covalentes, bien que l'interprétation soit similaire, il n'en est pas de même puisque ces liaisons partagent des électrons. Dans ces composés, on parle d'éléments plus électronégatifs, qui attirent une plus grande partie de la paire électronique et se retrouvent avec une charge plus négative, en fonction du nombre d'électrons qu'ils attirent. Cela peut être vu dans le formules de Lewis.
Si vous voulez savoir à quoi servent les formules chimiques, vous devez tenir compte du fait que ce nombre nous permet d'obtenir des informations sur les molécules, comment sont:
- La classe de lien qui se forment entre les atomes de la molécule ou du composé. Ces liaisons sont normalement covalentes lorsque des atomes non métalliques et ioniques y participent s'il s'agit de liaisons métalliques et non métalliques.
- La masse moléculaire de la molécule.
- Les nombre d'atomes de chaque élément qui compose la molécule. On l'appelle parfois la composition centésimale de la molécule.
- La masse exprimée en grammes qui aurait une mole de cette molécule.
Dans le cas d'un composé ionique, par exemple le chlorure de sodium ou le sel commun, il n'est pas strictement correct parler de molécules (même si c'est parfois le cas), que celles-ci ont tendance à former de gros agrégats et macromolécules. Dans ce cas, la formule du composé nous aide à voir quels ions le forment et en quelle quantité.

