परमाणु संरचना और विशेषताएं

छवि: स्लाइडप्लेयर
परमाणु हमारी दुनिया का हिस्सा हैं। सभी पदार्थ परमाणुओं से बने होते हैं, इसलिए यह बेहतर ढंग से समझना महत्वपूर्ण है कि वे किससे मिलकर बने हैं और उनके कार्य क्या हैं। एक शिक्षक के इस पाठ में हम आपको बताने जा रहे हैं कि एक परमाणु की संरचना और विशेषताएं. यदि आप उन कणों के बारे में अधिक जानना चाहते हैं जो सभी पदार्थ बनाते हैं, तो इस लेख को पढ़ते रहें।
सूची
- परमाणु क्या हैं?
- परमाणु की संरचना
- परमाणु की मुख्य विशेषताएं
- आइसोटोप क्या हैं?
- प्रकृति में परमाणु कैसे पाए जाते हैं?
परमाणु क्या हैं?
परमाणु यह है सबसे छोटी इकाई जिसमें पदार्थ को विभाजित किया जा सकता है अपने रासायनिक गुणों को खोए बिना, अर्थात रासायनिक तत्व के रूप में इसके गुण। आज सुबह सितारों से लेकर आपके नाश्ते तक, जो कुछ भी देखा या छुआ जा सकता है, उसका मूल परमाणु है।
यदि हम इसके रासायनिक गुणों के नुकसान को अलग रख दें, तो हम कह सकते हैं कि परमाणु विभिन्न कणों से बना है, जिन्हें उप-परमाणु कण कहा जाता है। उपपरमाण्विक कण तीन प्रकार के होते हैं -प्रोटॉन, न्यूट्रॉन और इलेक्ट्रॉन- विभिन्न विशेषताओं के साथ।
इन कणों को रासायनिक तत्वों (ऑक्सीजन, कार्बन, आदि) बनाने के लिए विभिन्न संख्याओं में समूहीकृत किया जाता है, लेकिन वे हमेशा एक निश्चित संरचना के अनुसार वितरित किए जाएंगे।

छवि: Google साइटें
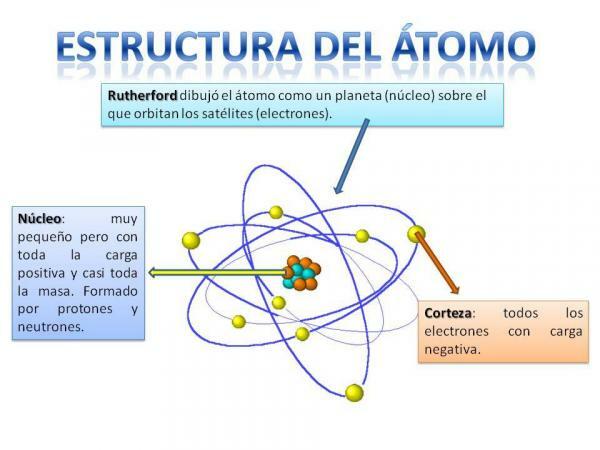
परमाणु की संरचना।
परमाणु की संरचना निश्चित होती हैयानी हमारे पास विभिन्न प्रकार के परमाणु (हाइड्रोजन परमाणु, ऑक्सीजन परमाणु, आदि) हो सकते हैं, लेकिन उनके उप-परमाणु कण हमेशा एक ग्रह प्रणाली के समान ही व्यवस्थित होते हैं।
आपको निश्चित रूप से याद होगा कि सौर मंडल कैसे व्यवस्थित होता है: सूर्य केंद्र में और आसपास है इससे ग्रह अलग-अलग कक्षाओं का वर्णन करते हुए घूमते हैं, कुछ करीब और कुछ इससे अधिक दूर रवि। परमाणुओं के मामले में, केंद्र में है कोर, एक ब्लैकबेरी के समान आकार के साथ और से बना है न्यूट्रॉन और यह प्रोटान.
कोर के आसपास है कॉर्टेक्स वह क्षेत्र कौन सा है जिसके माध्यम से इलेक्ट्रॉनों. पूर्व में यह सोचा गया था कि इलेक्ट्रॉनों ने कुछ कक्षाओं का वर्णन किया है, जैसा कि ग्रह कैसे करते हैं, हालांकि अब यह है जानता है कि ये कक्षाएँ इतनी अच्छी तरह से परिभाषित नहीं हैं और ऐसे क्षेत्रों की तरह हैं जिनमें हम खुद को खोजने की अधिक संभावना रखते हैं इलेक्ट्रॉन।
छवि: REA - प्लान Ceibal
परमाणु की मुख्य विशेषताएं।
परमाणु की संरचना और विशेषताओं पर इस पाठ को जारी रखने के लिए, उन तत्वों पर ध्यान देना महत्वपूर्ण है जो एक परमाणु को ऐसा मानते हैं।
और इसके लिए हमें इस प्रश्न का उत्तर देना होगा: सभी परमाणु स्वयं को उस निश्चित तरीके से व्यवस्थित करने का निर्णय क्यों लेते हैं? उत्तर सरल है: यह. के कारण है विद्युत आकर्षक बल. परमाणु का नाभिक न्यूट्रॉन से बना होता है, जिसमें कोई विद्युत आवेश नहीं होता है, और प्रोटॉन में एक धनात्मक विद्युत आवेश होता है। और इलेक्ट्रॉनों का एक ऋणात्मक विद्युत आवेश होता है, इसलिए नाभिक और इलेक्ट्रॉनों के बीच एक समान आकर्षक बल होता है चुंबक के दो ध्रुवों के बीच उत्पन्न होता है, लेकिन इलेक्ट्रॉनों के लिए "गिरने" के लिए पर्याप्त मजबूत नहीं होता है कोर।
यह बेहतर ढंग से समझा जाता है अगर हम ध्यान में रखते हैं मूल आकार: यदि परमाणु में, उदाहरण के लिए, एक फुटबॉल स्टेडियम का आयाम होता, तो केंद्र में केंद्र में गेंद का आयाम होता मैदान से स्टेडियम ब्लीचर्स पर गिरने के लिए सॉकर बॉल को कितना आकर्षक बल बनाना होगा!
न्यूट्रॉन का कार्य
अब आप सोच रहे होंगे कि न्यूट्रॉन क्या भूमिका निभाते हैं? विद्युत आवेश न होने के बावजूद, परमाणु के भीतर न्यूट्रॉन की एक बड़ी भूमिका होती है: वे 99% द्रव्यमान का योगदान करते हैं। अगर यह आपको याद रखने में मदद करता है, तो हम कह सकते हैं कि एक परमाणु तीन दोस्तों के गिरोह की तरह है: भारी न्यूट्रॉन, धनात्मक प्रोटॉन और ऋणात्मक इलेक्ट्रॉन, जो न्यूट्रॉन के चारों ओर चक्कर लगाते हैं और इलेक्ट्रॉन।
इलेक्ट्रॉनों की गति
इस बिंदु पर, मैं चाहता हूं कि हम उस चीज़ पर वापस जाएं जो हमने इंकवेल में छोड़ी थी: वे कक्षाएँ जिनका वर्णन इलेक्ट्रॉन नाभिक के चारों ओर करते हैं। हमने कहा था कि इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाते हैं जैसे ग्रह सूर्य के चारों ओर करते हैं, कुछ दूसरों की तुलना में करीब, वे ऐसा क्यों करते हैं? इलेक्ट्रॉनों को नाभिक से दूर जाने के लिए ऊर्जा के अनुसार एक कोश या दूसरे में घूमना पड़ता है, अर्थात जो इलेक्ट्रॉन नाभिक के करीब होते हैं, उनमें ऐसा नहीं होता है नाभिक से दूर जाने के लिए पर्याप्त बल जबकि क्रस्ट की सबसे बाहरी परतों (कक्षकों) में अधिक ऊर्जा होती है और वे नाभिक से और दूर जाने में सक्षम होते हैं। कोर। इसके अलावा, प्रत्येक कक्षा में अधिकतम 8 इलेक्ट्रॉनों की क्षमता होती है (ओकटेट नियम).
परमाणु के कण
हम एक और दृष्टिकोण पर लौटने जा रहे हैं जो हमने पहले किया है लेकिन समझाया नहीं है: परमाणु बने होते हैं न्यूट्रॉन, प्रोटॉन और इलेक्ट्रॉन, जो हमेशा नाभिक और क्रस्ट की एक ही संरचना का अनुसरण करते हुए संयोजित होते हैं, लेकिन वे विभिन्न रासायनिक तत्वों को बनाने के लिए विभिन्न संख्याओं में ऐसा करते हैं। हम केवल 3 प्रकार के कणों को मिलाकर इतने सारे तत्व कैसे प्राप्त कर सकते हैं? रासायनिक तत्व, जिन्हें आपने कभी आवर्त सारणी में दर्शाया है, एक निश्चित परमाणु संख्या होने की विशेषता है।
परमाणु संख्या (जेड) यह हमें इस प्रकार के परमाणु के नाभिक में प्रोटॉन की संख्या बताता है, जो सामान्य परिस्थितियों में इलेक्ट्रॉनों की संख्या के बराबर होता है। इस प्रकार, उदाहरण के लिए, सभी परमाणु जिनमें ६ प्रोटॉन (Z = ६) हैं, कार्बन परमाणु होंगे, और उनके रासायनिक गुण समान होंगे; 5 प्रोटॉन (Z = 5) वाले परमाणु बोरॉन परमाणु होंगे, जिनके रासायनिक गुण एक दूसरे के समान होंगे और कार्बन परमाणुओं से भिन्न होंगे। आपको परमाणु क्रमांक को परमाणु भार के साथ भ्रमित करने की आवश्यकता नहीं है या द्रव्यमान संख्या (ए), जो न्यूट्रॉन और प्रोटॉन के वजन का योग है (कुल नाभिक के वजन के संबंध में इलेक्ट्रॉनों का वजन नगण्य है)।

छवि: स्लाइडप्लेयर
आइसोटोप क्या हैं?
प्रकृति में हम तत्वों के विभिन्न "उपप्रकार" पा सकते हैं, आइसोटोप. मुझे यकीन है कि किसी समय आपने कार्बन 14 के बारे में सुना होगा, कार्बन का एक रेडियोधर्मी समस्थानिक जिसका उपयोग अन्य बातों के अलावा, जीवाश्मों की आयु निर्धारित करने के लिए किया जाता है। आइसोटोप हैं प्रोटॉन की समान संख्या वाले दो परमाणु (एक ही परमाणु संख्या), लेकिन न्यूट्रॉन की अलग-अलग संख्या, (अलग-अलग परमाणु द्रव्यमान)। एक ही तत्व के समस्थानिकों को आमतौर पर उस तत्व के नाम के साथ नाम दिया जाता है जिसके बाद उसका परमाणु द्रव्यमान होता है।
हमारे उदाहरण में, दोनों समस्थानिक कार्बन हैं, इसलिए उनकी परमाणु संख्या 6 (Z = 6) है और कार्बन 12 ("सामान्य" कार्बन) का परमाणु भार कार्बन 14. के परमाणु भार की तुलना में 12 है 14. एक ही तत्व के समस्थानिकों में बहुत समान रासायनिक और भौतिक गुण होते हैं। कार्बन 14 के मामले में, कार्बन 12 के विपरीत, यह एक रेडियोधर्मी आइसोटोप है जो जीवित प्राणियों सहित कार्बन युक्त सभी तत्वों में मौजूद है।
और इसी के साथ हम परमाणु की संरचना और विशेषताओं पर इस पाठ को समाप्त करते हैं। हमें उम्मीद है कि यह आपके लिए मददगार रहा है।

छवि: आपके कार्य
प्रकृति में परमाणु कैसे पाए जाते हैं?
परमाणुओं को अलगाव में पाया जा सकता है, लेकिन सबसे सामान्य बात उन्हें ढूंढना है समूहों में संयुक्त बुला हुआ अणुओं.
अणु एक ही तत्व के परमाणुओं से बने हो सकते हैं (जैसे ऑक्सीजन अणु, जो. के दो परमाणुओं से बने होते हैं) ऑक्सीजन) या विभिन्न तत्वों के परमाणुओं वाले समूहों द्वारा (हाइड्रोजन के दो परमाणु और ऑक्सीजन का एक अणु का अणु बनाते हैं) पानी)। तत्वों के इन समूहों को अणु कहा जाता है, जो बदले में एक दूसरे के साथ जोड़ा जा सकता है और उनकी प्रतिक्रियाशीलता और उनके रासायनिक संबंध के अनुसार अलग-अलग अधिक से अधिक जटिल समूह बनाते हैं का स्रोत रासायनिक लिंक.
अगर आप इसी तरह के और आर्टिकल पढ़ना चाहते हैं परमाणु संरचना और विशेषताएं, हम अनुशंसा करते हैं कि आप हमारी श्रेणी दर्ज करें परमाणु.

