A pozitív vagy negatív IONOK MEGHATÁROZÁSA

Mint már tudjuk, atomok által alkotják szubatomi részecskék. A három szubatomi részecske közül csak a neutronoknak nincs elektromos töltésük. Ehelyett a protonok pozitív elektromos töltéssel rendelkeznek, míg az elektronok negatív töltéssel. Csak az atom perifériáját elfoglaló elektronok vihetők át egyik atomról a másikra, míg a magban lévő protonok számukat stabilan tartják. A TANÁR ebben a leckében meglátjuk, mi történik, ha az atomok vagy molekulák elektronokat nyernek vagy veszítenek. Vagyis meglátjuk a pozitív vagy negatív ionok meghatározása és példái.
Index
- Mik azok az ionok? Könnyű meghatározás
- Ionképződés: elektro-affinitás és elektronegativitás
- Mik a negatív ionok? Példákkal
- Mik a pozitív ionok? Példákkal
Mik azok az ionok? Könnyű meghatározás.
A ion bármilyen atom vagy molekula nettó elektromos töltéssel. Vagyis egy atom vagy atomok összessége összekapcsolva, amelyek elektromos töltése nem kompenzálják. A töltések dekompenzációja akkor következik be, amikor egy vagy több elektron csatlakozik vagy elhagy egy atomot vagy atomcsoportot.
Az ionok tehát töltött atomok vagy molekulák, az elektronok (negatív töltésű és elhanyagolható tömegű szubatomi részecskék) nyeresége vagy vesztesége miatt.
Ion típusok: monatomikus és polyatomic
Ha figyelembe vesszük az ionok összetételét, két típust különböztetünk meg: monatomikus ionokat és polyatomos ionokat.
- Ahogy a neve is sugallja, monatomikus ionok azokat, amelyeket a egyetlen atom.
- Ionvegyületek o poliaatomos ionok azok, amelyekben az atomok kovalensen kapcsolódnak (egy vagy több elektronpárt osztanak meg a kötésben), amelyek számos neutronok az elektronok teljes számától eltérő molekulában.
- A poliaatomos ionok általában tartalmazzák oxigén és általában olyan szerkezetük van, amelynek központi atomja van, amely körül a molekula alkotó többi elem elrendeződik.
- A monatomikus ionok töltése a reprezentatív elemek közül (a táblázat 1. és 2. családja, valamint a periódusos rendszer 13–17. családja) könnyen levezethető, ha ismert a periódusos rendszeren belüli elhelyezkedésük. Ezekben az esetekben az atomok elektronokat nyernek vagy veszítenek annak érdekében, hogy vegyértékű héjában elérjék a korszak nemesgázának konfigurációját (s2o6), vagy ami ugyanaz, teljesítse a oktett szabály.
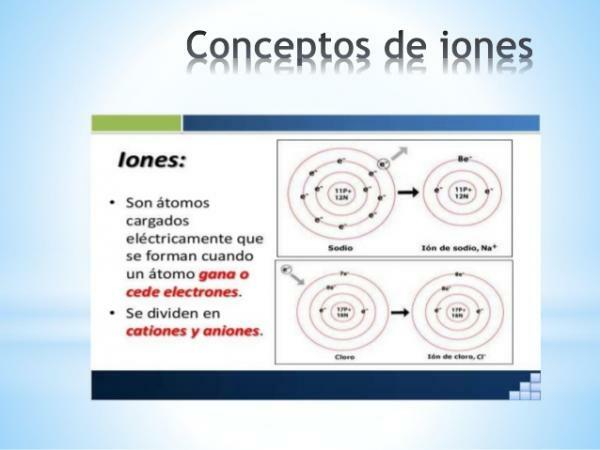
Kép: Slideshare
Ionképződés: elektroaffinitás és elektronegativitás.
Az atomok vagy molekulák képessége alkotnak ionokat két periodikus tulajdonság határozza meg: elektroaffinitás és elektronegativitás. Mindkét tulajdonság értéke egy periódus alatt növekszik, és csökken, amikor a periódusos rendszer egy csoportján vagy családján keresztül leereszkedünk.
A elektroafinitás, amelyet elektron-affinitásnak is neveznek, egy atomi tulajdonság, amelyet az atom elektronok vonzására való képességeként határozunk meg. A vegyületek esetében hasonló tulajdonság az ún elektronegativitás amely egy atom azon képessége, hogy vonzza az elektronokat, amikor kötést képez egy másik atomhoz. Mindkét tulajdonság tehát meghatározza az elem hajlamát az elektronok befogására vagy elvesztésére.
Ionos kötések
Szilárd formájukban az ionok vegyületeket vagy ionos kristályok (sók), különböző jelű ionok kombinációjával képződnek ionos kötések. Az ilyen típusú vegyületek legismertebb példája a konyhasó (nátrium-klorid: NaCl).
Az ionos kötés különböző előjelű ionok unióiból áll, elektrosztatikus vonzó erők (vonzás az ellentétes előjelű töltések között) révén. Az ilyen típusú kapcsolatokba olyan elemek lépnek be, amelyeknek elektronegativitása vagy elektro-affinitása nagyon különbözik (fémes és nem fémes elemek). A legtöbb esetben ezek az ionos vegyületek vízben oldódik és más poláris oldószerek.
Vizes oldatokban az ionos vegyületek szabad ionokká disszociálnak, amelyek ún elektrolitok, mivel az oldatban való jelenléte miatt a víz elektromos vezetőként viselkedik.
Mik a negatív ionok? Példákkal.
A negatív ionok Hívták őket anionok. Minden esetben nemfémes elemek vagy molekulák, amelyek nemfémes elemeket tartalmaznak. Ezeket az elemeket nagyon nagy elektro-affinitás és elektronegativitás jellemzi. Vagyis olyan ionok, amelyeket elemek alkotnak nagy az elektronok befogására való hajlam.
Monatomikus anionok: meghatározás és példák
Ezek a nemfémes elemek (a periódusos rendszer 13–17. Csoportja) atomjai által képzett anionok, amelyek egy vagy több elektronra tettek szert. Ezeknek az anionoknak közös a nemesgáz elektronikus szerkezete (i)2o6) a legkülső elektronhéjban (valenciahéj).
Példák:
- Kloridion: Cl-
- Fluoridion: F-
- Jodidion: I-
- Szulfidion: S-2
- Nitridion: N-3
Poliatomikus anionok: meghatározás és példák
Negatív töltésű ionok, amelyeket nemfémes elemek két vagy több atomja alkot, kovalens kötésekkel összekapcsolva. Ezek a leggyakoribb poliatomi ionok. A leggyakoribb poliatomi anionok az oxoanionok, amelyek központi nemfémes atomból állnak és oxigént tartalmaznak.
Általában kémiai vegyületeknek tekinthetők, ha egy savas vegyület elveszít egy vagy több protont (H+). Ezek a többatomos anionok megtarthatnak némi hidrogént a szerkezetükben, ami bizonyos savjelleget (a protonok lemondásának képességét) ad nekik.
Példák:
- Nitrátion: NO3-
- Permanganátion: MnO4-
- Foszfátion: PO4-3
- Hidrogén-karbonát vagy hidrogén-karbonát-ion: HCO3-
- Szulfition: SO3-2
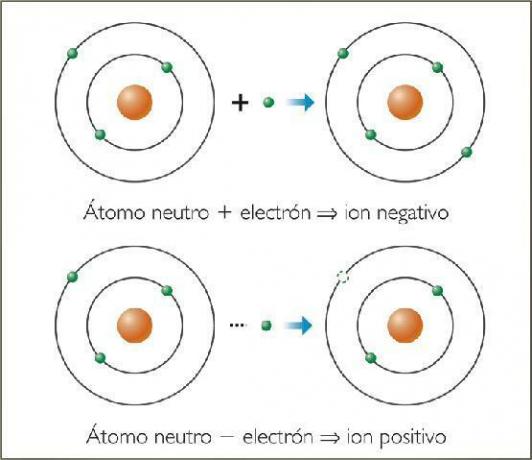
Kép: Természetgyógyászat
Mik a pozitív ionok? Példákkal.
Pozitív ionokat hívnak cciókat. Szinte minden esetben fémes elemek atomjai vagy molekulák, amelyek fémes elemeket tartalmaznak. Ezeket az elemeket nagyon alacsony elektro-affinitás és elektronegativitás jellemzi, ezért egyértelmű tendenciát mutatnak az elektronok elvesztésére.
Egyatomos kationok: meghatározás és példák
Olyan ionok, amelyek pozitív töltéssel rendelkeznek (az elektronveszteség miatt), amelyet egy fémes elem egyetlen atomja alkot. Ebben az esetben a kationt az elektronok elvesztése képezi, amelyek lehetővé teszik az elem számára a legkülső elektronikus réteg kiürítését és nemesgáz-konfiguráció (k) megszerzését.2o6) az alsó szintről. Ezek a leggyakoribb kationtípusok.
Példák:
- Hidrogén vagy hidron kation (más néven proton): H+
- Nátrium-kation: Na+
- Vas (III) kation vagy vas kation: Fe+3
- Kalcium-kation: Ca+2
- Réz (II) vagy réz kation: Cu+2
Poliatomikus kationok: meghatározás és példák
A többatomos kationok azok, amelyeket két vagy több atom alkot. Ritkák, a leggyakoribbak az úgynevezett homopolitómiai kationok, amelyek egynél többet tartalmaznak ugyanazon elem atomja, a trihidrogénion esetében az egyik leggyakoribb molekula a világegyetem. A különböző elemek atomjai által képzett poliatomi kationok nem gyakoriak, de jellemzők hidrogén jelenléte, és akkor tekinthető eredetnek, ha egy bázikus vegyület megfog egy protont (H+).
Példák:
- Ammónium kation: NH4+
- Oxonium-kation: HO3+
- Foszfónium-kation: PH3+
- Trihidrogén-kation vagy protonált molekuláris hidrogén: H3+
- Dimercury kation: Hg2+2
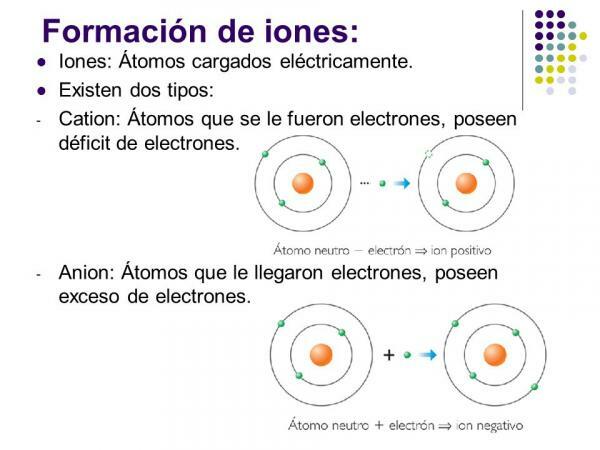
Kép: Bolygók
Ha további hasonló cikkeket szeretne olvasni Negatív és pozitív ionok: meghatározás és példák, javasoljuk, hogy adja meg a Az atom.
Bibliográfia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Alapvető kémia. Madrid: Uned



