A 10 típusú kémiai kötés (példákkal magyarázva)
A kémiai kötések a az atomokat összetartó erők hogy kialakítsák a molekulákat. Az atomok között háromféle kötés létezik:
- Fémes kötés.
- Ionos kötés.
- Kovalens kötés: nem poláris, poláris, egyszerű, kettős, hármas, datív.
Ezeknek a kötelékeknek köszönhetően a természetben létező összes vegyület képződik. Vannak olyan erők is, amelyek összetartják a molekulákat, úgynevezett intermolekuláris kötések, például:
- Hidrogénkötések vagy hidak.
- Dipólus-dipólus erők.
Ezután elmagyarázzuk ezeket a linkeket.
| A kémiai kötés típusai | Jellegzetes | Példák | |
|---|---|---|---|
| Fém | A fémionok a mozgó elektronok tengerében úsznak. | Fémes elemek: nátrium, bárium, ezüst, vas, réz. | |
| ión | Elektronok átvitelét egyik atomról a másikra. | Na nátrium-klorid+Cl- | |
| Kovalens | Nem poláris | Ossza meg az elektronokat egyenlően két atom között. | H-H vagy H molekuláris hidrogénatom2 |
| Poláris | Ossza meg az elektronokat egyenetlenül két atom között. | H vízmolekula2VAGY | |
| Egyszerű | Osszon meg pár elektronot. | Klórmolekula Cl2 Cl-Cl | |
| Kettős | Osszon meg két elektronpárt. | O oxigénmolekula2 O = O | |
| Hármas | Osszon meg három elektronpárt. | N≣N vagy N nitrogénmolekula2 | |
| Részeshatározó | Csak az atomok egyike osztja meg az elektronokat. | A nitrogén és a bór közötti kötés az ammónia-bór-trifluorid vegyületben. | |
| Intermolekuláris erők | Hidrogén híd | Az egyik molekulában lévő hidrogének vonzódnak egy másik molekula elektronegatív atomjaihoz. | A hidrogén az egyik vízmolekulában lévő hidrogén és a másik vízmolekula oxigénje között kötődik. |
| Dipólus-dipólus | A két elektromos pólussal rendelkező molekulák más molekulák ellentétes pólusait vonzzák. | A metanális H molekulák közötti kölcsönhatások2C = O |
Fémes kötés
A fémes kötés a fémes elemek pozitív ionjai és az ionok között szabadon mozgó negatív elektronok közötti vonzerő. A fématomok szorosan vannak csomagolva, ez lehetővé teszi az elektronok számára, hogy az atomok rácsán belül mozogjanak.
A fémekben a vegyértékű elektronok felszabadulnak eredeti atomjukból, és az elektronok "tengerét" képezik, amelyek a teljes fémszerkezet körül lebegnek. Ez azt eredményezi, hogy a fématomok pozitív töltésű fémionokká alakulnak át, amelyek egymásba pakolnak.
A fémes kötés létrejön olyan fémes elemek között, mint a nátrium-Na, a bárium-Ba, a kalcium-Ca, a magnézium-Mg, az arany Au, az ezüst Ag és az alumínium Al.
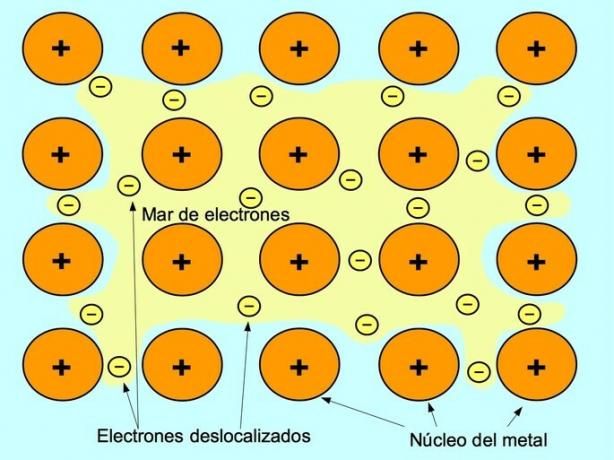
Ionos kötés
Az ionos kötés az az erő, amely egy fémes elemet, például nátriumot vagy magnéziumot összekapcsol egy nem fémes elemmel, például klórral vagy kénnel. A fém elveszíti az elektronokat és átalakul az úgynevezett pozitív fémionzá kation. Ezek az elektronok átjutnak a nemfémes elemhez, és ez átalakul negatív töltésű ionnak, az úgynevezettnek anion.
A kationok és az anionok háromdimenziós hálózatot alkotnak, amelyet a különböző töltésű ionok közötti elektrosztatikus vonzás erői tartanak fenn. Ezek az erők ionvegyületeket képeznek.
A földkéreg főleg ionos vegyületekből áll. A legtöbb kőzet, ásványi anyag és drágakő ionos vegyület. Például:
- Nátrium-klorid NaCl: a fémes elem a nátrium, amely elektront visz át klórhoz, amely nem fémes elem.
- Magnézium-klorid MgCl2: A magnézium-magnézium két elektront ad át két klóratomnak, amint az az alábbi ábrán látható:
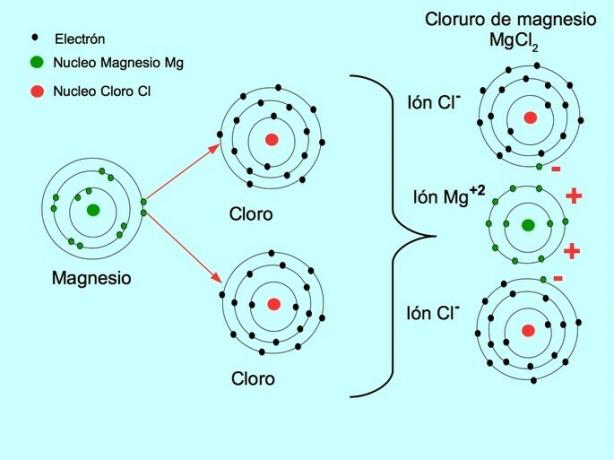
Lásd még A kationok és az anionok közötti különbség.
Kovalens kötés
A kovalens kötés akkor jön létre, amikor két nem fémes atom osztozik az elektronokon. Ez a kötés az atomok elektronjaihoz való affinitásától és a megosztott elektronok mennyiségétől függően többféle lehet.
Nempoláris kovalens kötés
A nempoláris kovalens kötés az a kötés, amely két atom között jön létre, ahol az elektronok egyenlően osztoznak. Ez a kötés általában szimmetrikus molekulákban fordul elő, vagyis két egyenlő atomból álló molekulákban, például a H hidrogénmolekulában.2 és az oxigénmolekula O2.

Poláris kovalens kötés
A poláris kovalens kötés akkor jön létre, amikor két atom megosztja az elektronokat, de egyikük nagyobb vonzerővel bír az elektronok iránt. Ezáltal a molekula negatívabb "pólussal" rendelkezik, több elektronnal, és az ellenkező pólus pozitívabb.
Az ilyen eloszlású vagy egyensúlyhiányos molekulákat polárisnak nevezzük. Például a hidrogén-fluorid-hidrogén-fluoridban kovalens kötés van a hidrogén és a fluor között, de a fluornak nagyobb az elektronegativitása, ezért erősebben vonzza az elektronokat megosztva.
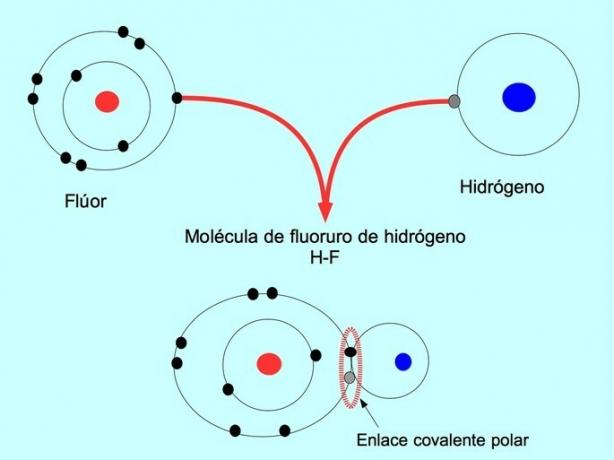
Egyszerű kovalens kötés
Amikor két atom két elektronon osztozik, mindegyikből egyet, a kialakult kovalens kötést egyetlen kovalens kötésnek nevezzük.
Például a klór olyan atom, amelynek külső héjában hét vegyértékelektron van, amelyet nyolc elektron tölthet be. A klór egy másik klórral egyesülve alkothatja a Cl klórmolekulát2 ami sokkal stabilabb, mint önmagában a klórok.
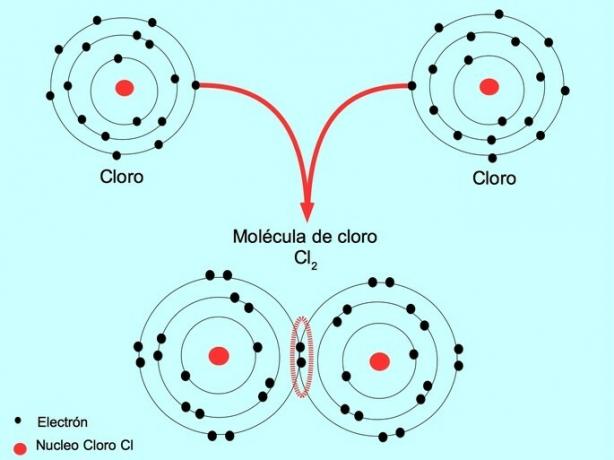
Kettős kovalens kötés
A kettős kovalens kötés az a kötés, ahol négy elektron (két pár) elektron megoszlik két atom között. Például az oxigén utolsó héjában 6 elektron van. Két oxigén kombinálásakor négy elektron oszlik meg a kettő között, így mindegyiknek 8 elektronja van az utolsó héjban.
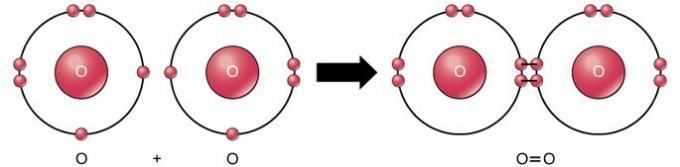
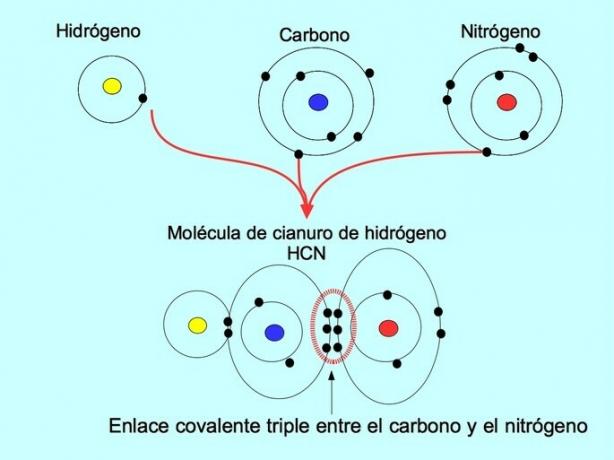
Hármas kovalens kötés
A hármas kovalens kötés akkor jön létre, amikor 6 elektron (vagy három pár) oszlik meg két atom között. Például a HCN hidrogén-cianid molekulában hármas kötés jön létre a szén és a nitrogén között, az alábbi ábra szerint:
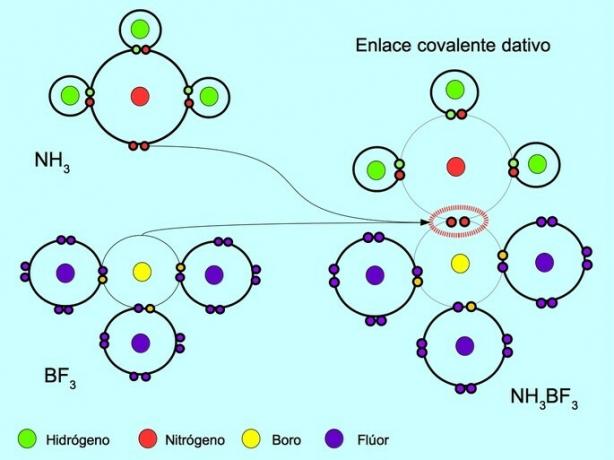
Koordináta vagy datatív kovalens kötés
A koordinált vagy datatív kovalens kötés az a kötés, amely akkor jön létre, amikor a kötésben lévő atomok közül csak az egyik hozzájárul elektronpárhoz. Például, ha az ammónia NH reagál3 BF-bór-trifluoriddal3, A nitrogén két elektronnal kötődik közvetlenül a bórhoz, amelynek megosztására nincs elérhető elektron. Ily módon mind a nitrogén, mind a bór 8 elektronnal marad a vegyértékhéjban.
Lásd még Szerves és szervetlen vegyületek.
Intermolekuláris kapcsolatok
A molekulák olyan erők révén kapcsolódnak össze, amelyek lehetővé teszik folyékony vagy szilárd állapotban lévő anyagok képződését.
Dipól-dipól kötések vagy erők
Gyenge intermolekuláris kötések létesülhetnek a poláris molekulák között, amikor a negatív pólusok vonzódnak a pozitív pólusokhoz, és fordítva. Például metanál H2C = O egy poláris molekula, amelynek részleges negatív töltése van az oxigénen, és részleges pozitív töltése van a hidrogéneken. Az egyik metanális molekula pozitív oldala vonzza a másik metanális molekula negatív oldalát.
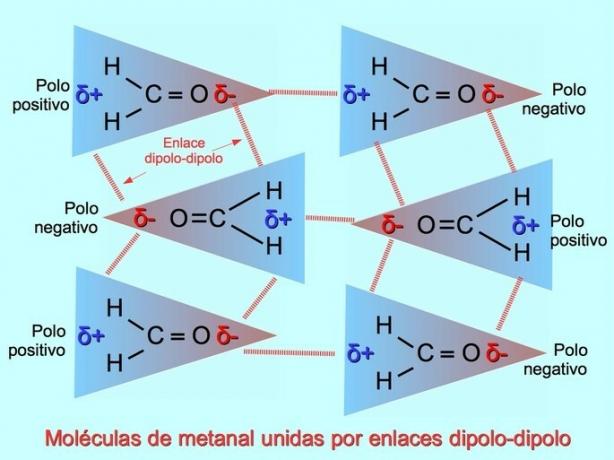
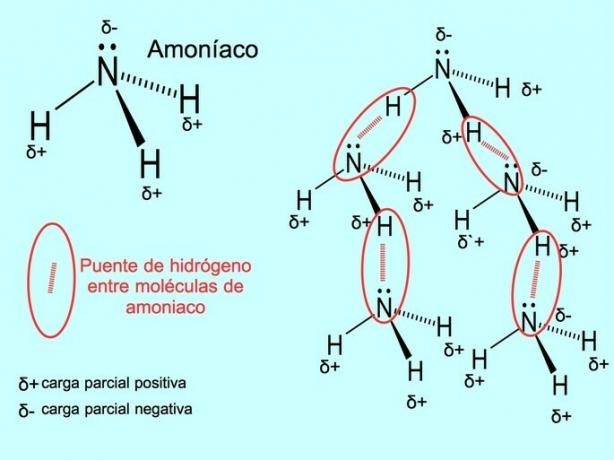
Hidrogénkötések vagy kötések
A hidrogénkötés vagy hidrogénkötés a molekulák között létrejövő kötés. Akkor fordul elő, amikor a molekulában lévő hidrogén kovalensen kapcsolódik egy oxigénhez, nitrogénhez vagy fluorhoz. Az oxigén, a nitrogén és a fluor nagyobb elektronegativitású atomok, ezért erősebben vonzzák az elektronokat, ha megosztják őket egy másik kevésbé elektronegatív atomdal.
A H vízmolekulák között hidrogénkötések vannak2O és ammónia NH3 amint a kép mutatja:
Érdekes lehet:
- Atomok és molekulák.
- Példák szerves és szervetlen vegyületekre.
- Fémek és nemfémek
Hivatkozások
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry. Kilencedik kiadás. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. kiadás. Pearson Ausztrália. Melbourne.


