A 10 típusú kémiai elem (magyarázva és osztályozva)
Hány kémiai elemnek kell léteznie az univerzumban? Ehhez a kérdéshez még hosszú út áll, mivel a tudósok időről időre saját mesterséges kémiai elemeket hoznak létre.
Amire azonban válaszolhatunk, az az hányféle kémiai elemnek kell léteznie, amit legközelebb megtudunk.
- Kapcsolódó cikk: "A 11 kémiai reakció"
A kémiai elemek típusai
A természetben mindenféle anyag megtalálható. Ezek az anyagok általában nem találhatók meg tiszta állapotukban, hanem a különböző anyagok kombinációjának eredményei olyan elemek vagy anyagok, amelyek különböző reakciók, folyamatok és időtartamok révén mindenféle keletkezéshez vezettek ügy. Nincs semmi az univerzumban, ami ne a különböző típusú kémiai elemekhez tartozó atomok kombinációjának eredménye lenne, amelyet mélyen látni fogunk.
Mielőtt azonban megvizsgálnánk a kémiai elemek típusait, tegyünk egy kis áttekintést a középiskolai tudományról, és emlékezzünk a kémiai elemekre.
"Kémiai elemnek" nevezzük az anyagot, amely azonos típusú atomokból áll, vagyis atomilag tiszta anyagból.
A kémiai elemeket nem lehet egyszerűbbekre bontani, és a periódusos rendszerbe sorolják az elemeket, mint a világegyetem tiszta anyagait.De vigyázz! Nem szabad összetéveszteni az elemeket az egyszerű anyagokkal, mivel bizonyos esetekben ugyanazon elem két vagy több atomja alkothat különböző módon csoportosított molekulák, amelyek miatt a szóban forgó elem fizikai tulajdonságainak némelyike eltérhet, ezek az esetek a izotópok. Például a gyémánt és a szén a szén (C) kémiai elemből készült anyagok. de ez különböző módon szerveződik, és két teljesen különböző anyagot eredményez.
Carl sagan Azt mondta, hogy csillagpor vagyunk, csillagokra reflektálva. Ez a gyönyörű mondat nem puszta metafora, hanem tudományos tény. Tudomásunk szerint a kémiai elemek komplexek eredményeként keletkeznek a csillagok belsejében fúziós és atomhasadási folyamatok, amelyek egyre nehezebb elemeket hoznak létre, az úgynevezett folyamat eredménye nukleoszintézis.
A legtöbb ismert elem a természetből származik, spontán talált, vagy más elemekkel, például urán (U), szén (C), szilícium (Si), ezüst (Ag) vagy arany (Au) vegyületeket képez. Másokat viszont olyan laboratóriumokban gyártottak, mint az americium (Am), a berkelium (Bk) vagy a curium (Cm). Függetlenül attól, hogy milyen módon szerezte be, vagy ha jelen van a természetben, tulajdonságaitól függően a szóban forgó kémiai elemnek lesz bizonyos vagy más felhasználási módja.
Jelenleg mintegy 118 kémiai elem ismert, bár figyelembe véve, hogy az emberek képesek voltak új elemek előállítására, idő kérdése, hogy a periódusos rendszer kibővüljön.
- Érdekelhet: "A kétféle villamos energia (magyarázat)"
A kémiai elemek fő típusai
A kémiai elemek fő típusait a periódusos rendszer mutatja be besorolását Dmitrij Mendelejev (1834-1907) orosz kémikus alkotta meg, aki megalapozta az alapokat 1869. A kémiai elemeket tulajdonságaik és jellemzőik alapján vizuálisan rendezzük.
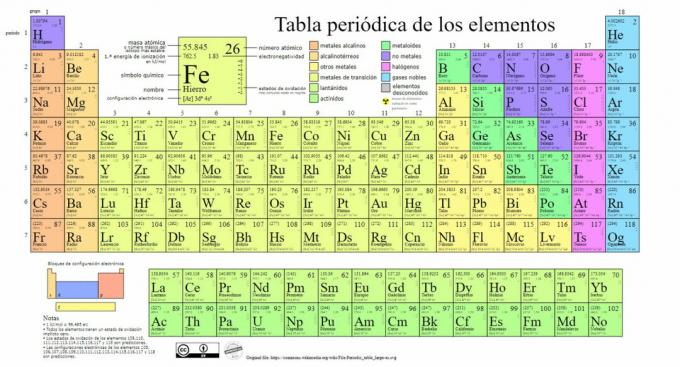
Idővel és mivel a kémia fontos tudományos felfedezéseket tett, ezt a táblázatot folyamatosan bővíteni fogják, az eddig ismert 118 elemmel elérte azt a formáját, amely ma van.
Jelenleg ebben a táblázatban a következő típusú kémiai elemeket találjuk:
1. Fémek
A fémek azok kémiai elemek, amelyek általában egy -három elektronot tartalmaznak atomjuk utolsó pályáján, elektronok, amelyek könnyen átvihetők hő- és áramvezetőkké teszik őket.
A fémek általában képlékenyek és képlékenyek, jellegzetes ragyogással, amelynek intenzitása az atomjaikat alkotó elektronok mozgásától függ. A fémek legtöbbször szobahőmérsékleten szilárdak, kivéve a higanyt.
A fémek között aranyat (Au), ezüstöt (Ag), rézt (Cu) és alumíniumot (Al) találunk, amelyek fizikai tulajdonságai miatt csodálatos elektromos vezetők., bár jelenlétük a természetben nagyon változatos, tükröződik súlyuk közötti különbségben.
Úgy gondolják, hogy a természetben létező kémiai elemek 75% -a fém, míg a fennmaradó 25% nemesgázokból, metalloidokból és más típusokból állna.
Ebben a kategóriában vannak besorolások, amelyek aktinideket, lantanidokat, átmeneti fémeket, alkálifémeket, alkáliföldfémeket és más fémeket találnak.
- Kapcsolódó cikk: "10 magas cinktartalmú étel"
1.1. Lantanidok
A lantanid elemek sok ásványból álló lerakódásokban találhatók. Ezek fehér fémek, amelyek levegővel érintkezve könnyen oxidálódnak. Közöttük találjuk a lantánt (La), a prométiumot (Pm), az európiumot (Eu) és az Ytterbiumot (Yb).

- Érdekelhet: "Az ötféle kémiai kötés: így áll össze az anyag"
1.2. Aktinidák
Az aktinidák minden izotópja radioaktív. Közöttük találunk aktíniumot (Ac), uránt (U), plutóniumot (Pu) és einsteiniumot (Es).
1.3. Átmeneti fémek
Az átmeneti fémek a periodikus rendszer központi részében helyezkednek el. Fő jellemzője, hogy a "d" pálya elektronikus konfigurációja részben elektronokkal van tele.
Ebbe a csoportba mindenféle anyag tartozik, és a legszélesebb osztályozása szerint 21-30, 39-48 közötti kémiai elemeknek felelne meg, 71 -től 80 -ig és 103 -tól 112 -ig, összesen negyven, köztük vanádiumot (V), ruténiumot (Ru), ezüstöt (Ag), tantált (Ta) és Lawrencio -t (Lr).

1.4. Alkálifémek
Az alkálifémek hat elemből álló csoportból állnak, amelyek lítium (Li), nátrium (Na), kálium (K), rubídium (Rb), cézium (Cs) és francium (Fr). Fényes, lágy fémek, normál hőmérsékleten és nyomáson nagyon reakcióképesek, és könnyen elveszítik külső elektronjukat, amely az "s" pályájukon található.
1.5. Lúgos földek
Az alkáliföldfémek olyan elemek csoportja, amelyekben berillium (Be), magnézium (Mg), kalcium (Ca), stroncium (Sr), bárium (Ba) és rádium (Ra) található. Neve az oxidjainak, a "földeknek", amelyek bázikus vagy lúgos tulajdonságokkal rendelkeznek.
Az alkáliföldek keményebbek, mint lúgosak, ragyognak és jó elektromos vezetők. Kevésbé reakcióképesek, mint a lúgosak, és jó redukálószerek. Képesek ionos vegyületeket képezni, és mindegyiküknek két elektronja van a legkülső héjában.

1.6. Más fémek
Az "egyéb fémek" kategória az egyfajta anyag, amely azért található itt, mert nem igazán tudja, hová tegye.
Ezek fémes elemek, amelyek a periódusos rendszerben, a metalloidokkal együtt, a p blokkon belül helyezkednek el. Lágyak, alacsony olvadáspontúak. Többek között alumínium (Al), indium (In), ón (Sn) és bizmut (Bi).

2. Nem tartalmaz fémeket
A nemfémek általában öt -hét elektronot tartalmaznak az utolsó pályájukon, ez a tulajdonság hogy elektronokat nyernek ahelyett, hogy feladnák őket, és így sikerül nyolc elektronjukkal rendelkezniük, amelyek így stabilizálják őket atomok.
Ezeket az elemeket nagyon rossz hő- és áramvezetők. Hozzátéve, hogy nincs jellegzetes fényük, nem nagyon képlékenyek, nem nagyon képlékenyek és szilárd állapotban nagyon törékenyek. A fémekkel ellentétben nem lehet tekerni vagy nyújtani.
Többnyire elengedhetetlenek a biológiai rendszerekhez, mivel jelen vannak a szerves vegyületek, például kén (S), szén (C), oxigén (O), hidrogén (H) és jód (I).

- Kapcsolódó cikk: "A 20 fajta drágakő (leírva és képekkel)"
3. Metalloidok
Ahogy a nevük is sugallja, a metalloidok azok köztes osztályozás a fémek és a nemfémek között, amelyek mindkét csoport tulajdonságaival rendelkeznek. Ez annak a ténynek köszönhető, hogy utolsó atompályájukon négy atom található, ami a fémek és nemfémek köztes mennyisége.
Ezek a kémiai elemek csak egy irányban vezetik az elektromosságot, nem teszik lehetővé, hogy az ellenkező irányba történjen, mint a fémekben. Erre példa a szilícium (Si), amely a félvezető elemek elektronikai ipar számára történő gyártásához használt metalloid, ennek a tulajdonságának köszönhetően.
Egyéb metalloidok: bór (B), arzén (As), antimon (Sb) és polónium (Po).

4. Halogének
A halogének hat elemből álló csoport, amelyek hajlamosak két atomból (kétatomos) álló molekulákat alkotni, elektronegativitásuk miatt nagyon kémiailag aktívak.
Ezek az anyagok általában ionok, azaz elektromosan töltött molekulák formájában jelennek meg, amelyek ebben az esetben mononegatívak, erősen oxidálóak. Ez azt jelenti, hogy a halogének maró és maró anyagok.
A halogének a következők: fluor (F), klór (Cl), bróm (Br), jód (I), asztát (At) és tenesz (Ts).

5. nemesgázok
A nemesgázok héttagúak, amelyek természetes állapota gáz halmazállapotú. Általában nagyon alacsony reakcióképességű kétatomos molekulák formájában jelennek meg, vagyis nem reagálnak más anyagokat alkotó elemekkel. és ugyanezen okból közömbös gázokként ismertek. Ennek az az oka, hogy az utolsó pályáján az adott szinten elérhető maximális elektronszám van, összesen nyolc.
Ez a kiválasztott elemcsoport héliumból (He), neonból (Ne), argonból (Ar), kriptonból (Kr), xenonból (Xe), radonból (Rn) és oganesonból (Og) áll, amelyeket korábban ununctiumnak hívtak.