Evolusi TABEL PERIODIK: dari pembuatannya hingga hari ini
Tabel periodik merupakan salah satu dari ikon paling ikonik dari ilmu tersebut. Meskipun 2019 adalah peringatan 150 tahun pembuatannya, itu sama sekali bukan dokumen yang sudah jadi. Dalam pelajaran dari GURU ini kita akan melihat apa yang evolusi tabel periodik dari penciptaannya hingga hari ini dan kemajuan apa dalam pengetahuan tentang atom dan sifat-sifatnya yang memungkinkannya.
Indeks
- Apa itu tabel periodik?
- Tabel periodik pertama: asal
- Sejarah tabel periodik dan evolusi
Apa itu tabel periodik?
Itu tabel periodik Sistem periodik unsur adalah dokumen ilmiah yang memusatkan lebih banyak informasi dalam ruang yang lebih kecil dan merupakan salah satu ikon ilmu pengetahuan yang paling kuat. Ini berisi bagian yang baik dari pengetahuan yang kita miliki tentang kimia. Tidak ada dokumen serupa dalam disiplin ilmu lainnya.
tabel periodik unsur adalah sistem klasifikasi unsur kimia Itu dimulai lebih dari 200 tahun yang lalu. Sistem klasifikasi ini telah berkembang dan berubah dari waktu ke waktu, seiring dengan kemajuan ilmu pengetahuan dan penemuan-penemuan baru.
unsur kimia. Namun, berbagai modifikasi telah dimasukkan dengan menjaga struktur dasarnya tetap utuh.Tabel periodik dinamakan demikian karena diekspresikan secara grafis cara mereka mengulangi secara berkala tertentu sifat kimia. Ini adalah jenis representasi dua dimensi atau, dalam representasi yang lebih modern, tiga dimensi.
Dalam tabel periodik klasik (dua dimensi) unsur-unsur kimia diatur dalam kelompok atau keluarga dan disajikan dalam tabel periodik saat ini dalam kolom vertikal. Susunan teratur dari kelompok-kelompok ini dalam kolom menghasilkan serangkaian baris, yang disebut periode, di mana unsur-unsur diatur menurut berat atomnya. Tabel periodik terdiri dari tujuh periode yang panjangnya bervariasi.

Tabel periodik pertama: asal.
Sebelum Mendeleev, ilmuwan lain telah mengembangkan sistem klasifikasi untuk unsur kimia. Tapi, tidak seperti tabel periodik unsur, mereka adalah hanya daftar elemen yang diketahui; sedangkan tabel periodik memiliki kekhasan yaitu sistem klasifikasi dua dimensi (baris dan kolom) atau tiga dimensi, dalam versi paling modernnya, di mana unsur-unsur kimia disusun secara berurutan lapisan.
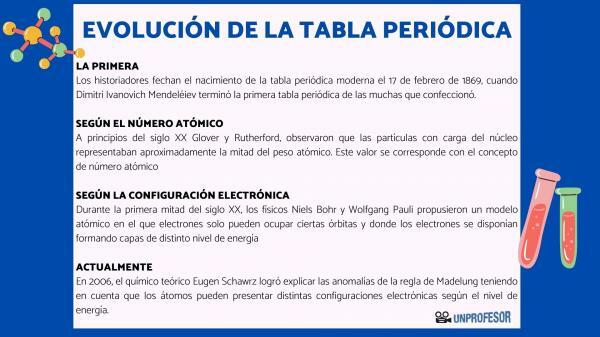
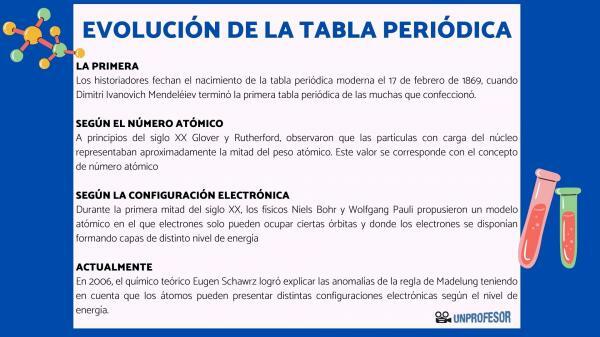
Karena alasan ini, para sejarawan memberi tanggal lahirnya tabel periodik modern pada 17 Februari 1869, kapan Dimitri Ivanovich Mendeleev selesaikan tabel periodik pertama dari sekian banyak yang dia buat. Tabel ini terdiri dari 63 elemen yang diatur dalam keluarga dan meninggalkan ruang kosong untuk elemen yang belum ditemukan, tetapi dari mana ia telah menyimpulkan berat atom mereka (seperti dalam kasus Gallium, Germanium, dan Skandium)
Data kunci untuk penemuan tabel periodik adalah pengetahuan sebelumnya tentang berat atom dari setiap elemen.
Apa yang dimaksud dengan berat atom dan nomor atom?
Nomor ini mewakili berat atom dan itu adalah satu-satunya nilai terukur dari atom. Tapi itu tidak dalam kasus pengukuran langsung (tidak ada alat pengukur yang memungkinkan menimbang atom terisolasi) melainkan mereka adalah sistem yang didirikan standar di mana nilai sewenang-wenang 1 diberikan kepada atom hidrogen dan nilai berat atom dari unsur-unsur yang tersisa dihitung sehubungan dengan ini Pola.
Perhitungan pertama dari nomor atom unsur-unsur dilakukan oleh ahli kimia Inggris English John dalton, dan menghasilkan perdebatan ilmiah yang hebat selama paruh pertama abad ke-19. Namun, pada paruh kedua abad ke-19, sudah ada konsensus yang luar biasa tentang sistem untuk menghitung berat atom unsur. Berat atom menjadi dari Mendeleev dan seterusnya, kriteria kunci untuk urutan yang benar dari unsur-unsur dalam tabel periodik.
Ketika Mendeleev mengurutkan unsur-unsur yang diketahui menurut pertambahan berat atom, mengamati munculnya sifat berulang yang memungkinkan unsur-unsur untuk dikelompokkan ke dalam kelompok atau keluarga unsur-unsur yang mirip satu sama lain. Namun, dalam beberapa kasus, pengurutan unsur-unsur menurut berat atomnya tidak menanggapi kesamaan antara unsur-unsur yang diamati dan Mendeleev berubah. posisi 17 unsur dalam susunan tabel periodik terlepas dari berat atomnya, agar dapat mengelompokkannya dengan unsur-unsur yang analoginya disajikan.
Perubahan ini menunjukkan bahwa beberapa berat atom yang diterima tidak benar dan dihitung ulang. Meskipun ada koreksi dalam berat atom, masih ada unsur-unsur yang harus ditempatkan pada posisi selain yang ditunjukkan oleh berat atomnya.

Gambar: BBC.com
Sejarah tabel periodik dan evolusi.
Terlepas dari kontribusi Mendeleev yang tidak diragukan, tabel periodik unsur bukanlah hasil karya seorang peneliti tunggal. Selain Mendeleev, selama paruh kedua abad kesembilan belas dan sepanjang abad kedua puluh banyak Ahli kimia terus menyelidiki cara terbaik untuk mengatur informasi tentang unsur-unsur kimia diketahui. Terlebih lagi mengingat selama ini ditemukannya unsur kimia baru atau zat sederhana, berkat spektrometri (yang mempelajari interaksi antara atom dan radiasi elektromagnetik).
Itu klasifikasi elemen dalam tabel periodik awalnya didasarkan pada perhitungan awal dari berat atom dari unsur-unsur dan mengungkapkan analogi yang memungkinkan unsur-unsur untuk dikelompokkan ke dalam keluarga analog. Meski begitu, alasan munculnya sifat-sifat periodik ini tidak dapat dijelaskan. Itu sepanjang abad ke-20, dengan penemuan struktur elektronik, ketika alasan periodisitas dalam sifat-sifat unsur dipahami.
Nomor atom sebagai kriteria pengurutan
Pada awal abad ke-20 Glover dan Rutherford, mengamati bahwa partikel bermuatan inti menyumbang sekitar setengah berat atom. Nilai ini sesuai dengan konsep nomor atom yang didefinisikan sebagai jumlah proton dalam inti atom dan yang bertepatan dengan jumlah elektron dalam atom netral. Nilai baru ini membenarkan adanya perubahan posisi unsur-unsur tertentu yang selama ini dilakukan. Misalnya perubahan posisi antara telurium dan yodium.
Pada tahun 1913, Henry Moseley mengkonfirmasi urutan tabel sebagai fungsi nomor atom dengan spektrometri sinar-X. Pengurutan menurut nomor atom masih berlaku sampai sekarang.
Pada saat yang sama, selama abad ke-20, unsur-unsur kimia baru terus ditemukan berkat mekanika kuantum dan perkembangan teknik pengeboman atom oleh partikel, dari paruh kedua abad ini. Dengan teknik baru ini dimungkinkan untuk membuat elemen buatan yang tidak ada di alam.
Meskipun kemajuan telah dibuat dalam pengaturan yang benar dari unsur-unsur dalam tabel periodik, tetap saja alasan terjadinya berulang dari sifat-sifat tertentu (properti berkala). Perkembangan dari mekanika kuantum (cabang fisika yang mempelajari perilaku cahaya dan atom pada skala mikroskopis) dari tahun 1920 sangat menentukan untuk menjelaskan alasan sifat-sifat ini.
Konfigurasi elektron sebagai penjelasan dari sifat periodik
Selama paruh pertama abad ke-20, fisikawan Niels Bohr kamu Wolfgang Pauli mereka mengusulkan model atom di mana elektron hanya dapat menempati orbit tertentu dan di mana elektron disusun membentuk lapisan tingkat energi yang berbeda. Cara di mana elektron didistribusikan dalam orbital di kulit yang berbeda atau tingkat energi dikenal sebagai konfigurasi elektronik.
Penemuan susunan elektron dalam konfigurasi elektron merupakan dasar untuk memahami periodisitas sifat-sifat periodik, karena diamati bahwa sifat-sifat ini terkait erat dengan konfigurasi elektron terluar atom (lapisan Valencia).
Urutan elektron mengisi orbital atom ditetapkan pada tahun 1930 oleh fisikawan Erwin Madelung yang menetapkan aturan numerik untuk urutan pengisian. Aturan ini dikenal sebagai Aturan Madelung dan itu adalah aturan empiris yang tidak dapat dijelaskan melalui mekanika kuantum.
Urutan pengisian sederhana untuk tiga baris pertama tabel periodik, tetapi dalam baris keempat, di mana elemen transisi berada, urutan pengisian mengalami serangkaian: perubahan. Ada total 20 item anomali yang tidak mengikuti aturan ini.
Evolusi tabel berlanjut hari ini
Pada tahun 2006, ahli kimia teoretis Eugen Schawrz Dia berhasil menjelaskan anomali aturan Madelung dengan mempertimbangkan bahwa atom dapat memiliki konfigurasi elektronik yang berbeda tergantung pada tingkat energinya. Menghitung rata-rata, konfigurasi elektron dari sebagian besar unsur memang sesuai dengan aturan Madelung.
Tabel periodik tetap menjadi bahan perdebatan di abad ke-21, meskipun pengaturan atau konfigurasi elektronik dari unsur-unsur, masih valid untuk menjelaskan urutan ini dan anomali yang diamati dalam konfigurasi elektronik melalui a teori.
Jika Anda ingin membaca lebih banyak artikel serupa dengan Evolusi tabel periodik - ringkasan, kami sarankan Anda memasukkan kategori kami atom.
Bibliografi
Berbagai penulis. (2019)Khusus: tabel periodik. Penelitian dan ilmu pengetahuan. Barcelona: Scientific Press S.A.



