DEFINIZIONE di IONI positivi o negativi

Come già sappiamo, atomi sono formati da particelle subatomiche. Dei tre tipi di particelle subatomiche, solo i neutroni non hanno carica elettrica. Invece, i protoni hanno una carica elettrica positiva mentre gli elettroni hanno una carica negativa. Solo gli elettroni, che occupano la periferia dell'atomo, possono essere trasferiti da un atomo all'altro, mentre i protoni nel nucleo mantengono stabile il loro numero. In questa lezione di un INSEGNANTE vedremo cosa succede quando atomi o molecole acquistano o perdono elettroni. Cioè, vedremo la definizione e gli esempi di ioni positivi o negativi.
Indice
- Cosa sono gli ioni? Facile definizione
- Formazione di ioni: elettroaffinità ed elettronegatività
- Cosa sono gli ioni negativi? Con esempi
- Cosa sono gli ioni positivi? Con esempi
Cosa sono gli ioni? Definizione facile.
UN ione è qualsiasi atomo o molecola con carica elettrica netta. Cioè, è un atomo o un insieme di atomi collegati tra loro, le cui cariche elettriche
non sono compensati. Questo scompenso delle cariche si verifica quando uno o più elettroni si uniscono o lasciano un atomo o un insieme di atomi.Gli ioni sono così atomi o molecole carichi, per guadagno o perdita di elettroni (particelle subatomiche con carica negativa e massa trascurabile).
Tipi di ioni: monoatomici e poliatomici
Se si tiene conto della composizione degli ioni si distinguono due tipi: ioni monoatomici e ioni poliatomici.
- Come suggerisce il nome, ioni monoatomici quelli formati da a singolo atomo.
- Composti ionici o ioni poliatomici sono quelli in cui gli atomi sono legati covalentemente (condividono una o più coppie di elettroni nel legame) presentando un numero di neutroni nella molecola diverso dal numero totale di elettroni.
- Il ioni poliatomici di solito contengono ossigeno e di solito hanno una struttura con un atomo centrale attorno al quale sono disposti i restanti elementi che compongono la molecola.
- Il carica di ioni monoatomici degli elementi rappresentativi (famiglie 1 e 2 della tavola e famiglie da 13 a 17 della tavola periodica) possono essere facilmente dedotti se è nota la loro posizione all'interno della tavola periodica. In questi casi gli atomi acquistano o perdono elettroni per raggiungere, nel loro guscio di valenza, la configurazione del gas nobile del suo periodo (S2p6), o che è lo stesso, adempiere al regola dell'ottetto.
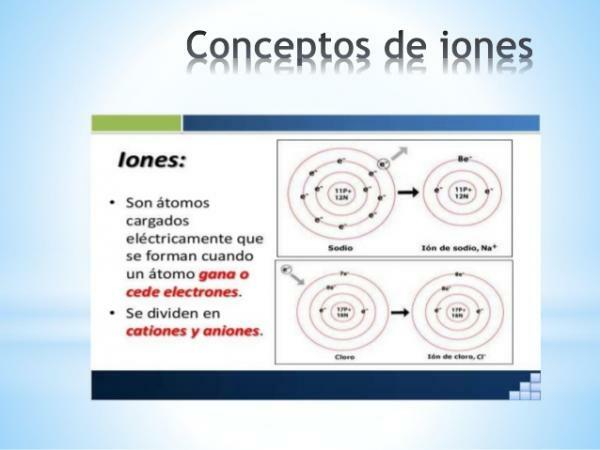
Immagine: Slideshare
Formazione di ioni: elettroaffinità ed elettronegatività.
La capacità degli atomi o delle molecole di formare ioni è determinato da due proprietà periodiche: elettroaffinità ed elettronegatività. Entrambe le proprietà aumentano di valore in un periodo e diminuiscono man mano che si scende attraverso un gruppo o una famiglia della tavola periodica.
Il elettroaffinità, chiamata anche affinità elettronica, è una proprietà atomica definita come la capacità di un atomo di attrarre elettroni. Nel caso dei composti, una proprietà simile chiamata elettronegatività che è definita come la capacità di un atomo di attrarre elettroni quando forma un legame con un altro atomo. Entrambe le proprietà definiscono quindi la tendenza di un elemento a catturare o perdere elettroni.
legami ionici
Nella loro forma solida, gli ioni formano composti o cristalli ionici (sali), formato dalla combinazione di ioni di segno diverso uniti tra loro per mezzo di legami ionici. L'esempio più noto di questo tipo di composto è il sale comune (Sodio cloruro: NaCl).
Il legame ionico è costituito da unioni di ioni di segno diverso mediante forze attrattive elettrostatiche (attrazione tra cariche di segno opposto). In questo tipo di collegamenti intervengono elementi la cui elettronegatività o elettroaffinità è molto diversa (elementi metallici e non metallici). Nella maggior parte dei casi, questi composti ionici sono solubile in acqua e altri solventi polari.
In soluzioni acquose, i composti ionici si dissociano in ioni liberi, chiamati elettroliti, poiché la sua presenza nella soluzione fa sì che l'acqua si comporti come un conduttore elettrico.
Cosa sono gli ioni negativi? Con esempi.
Il ioni negativi Sono chiamati anioni. In tutti i casi, sono atomi di elementi non metallici o molecole che contengono elementi non metallici. Questi elementi sono caratterizzati dall'avere un'elevata affinità ed elettronegatività. Cioè, sono ioni formati da elementi con un'elevata tendenza a catturare elettroni.
Anioni monoatomici: definizione ed esempi
Sono gli anioni formati da atomi di elementi non metallici (gruppi da 13 a 17 della tavola periodica), che hanno acquisito uno o più elettroni. Questi anioni hanno in comune la struttura elettronica dei gas nobili (s2p6) nel suo guscio elettronico più esterno (guscio di valenza).
Esempi:
- Ione cloruro: Cl-
- Ione fluoruro: F-
- Ione ioduro: I-
- Ione solfuro: S-2
- Ione nitruro: N-3
Anioni poliatomici: definizione ed esempi
Sono ioni carichi negativamente formati da due o più atomi di elementi non metallici legati da legami covalenti. Sono gli ioni poliatomici più comuni. Gli anioni poliatomici più comuni sono gli ossoanioni, che sono costituiti da un atomo centrale non metallico e contengono ossigeno.
In generale, sono considerati composti chimici ottenuti quando un composto acido perde uno o più protoni (H+). Questi anioni poliatomici possono trattenere dell'idrogeno nella loro struttura, il che conferisce loro un certo carattere acido (capacità di cedere protoni).
Esempi:
- Ione nitrato: NO3-
- Ione permanganato: MnO4-
- Ione fosfato: PO4-3
- Ione idrogenocarbonato o bicarbonato: HCO3-
- Ione solfito: SO3-2
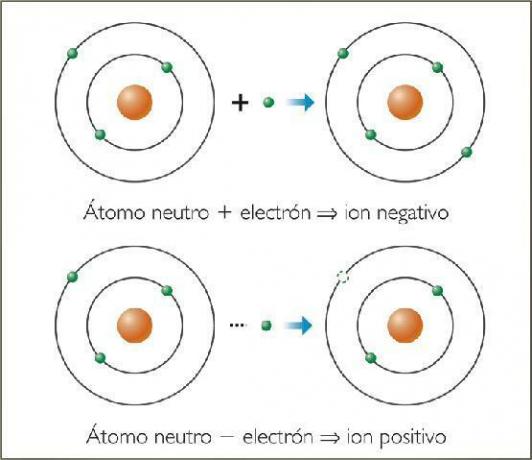
Immagine: Naturopatia
Cosa sono gli ioni positivi? Con esempi.
Gli ioni positivi sono chiamati cazioni. Questi sono, nella quasi totalità dei casi, atomi di elementi metallici o molecole che contengono elementi metallici. Questi elementi sono caratterizzati dall'avere un'elettroaffinità e un'elettronegatività molto basse, motivo per cui mostrano una chiara tendenza a perdere elettroni.
Cationi monoatomici: definizione ed esempi
Sono ioni con carica positiva (dovuta alla perdita di elettroni) formati da un singolo atomo di un elemento metallico. In questo caso, il catione è formato dalla perdita di elettroni che consentono all'elemento di svuotare il suo strato elettronico più esterno e acquisire una configurazione di gas nobile (s2p6) dal livello inferiore. Sono il tipo più comune di catione.
Esempi:
- Idrogeno o catione idronico (chiamato anche protone): H+
- Catione di sodio: Na+
- Catone ferro (III) o catione ferrico: Fe+3
- Catione di calcio: Ca+2
- Rame (II) o catione rameico: Cu+2
Cationi poliatomici: definizione ed esempi
I cationi poliatomici sono quelli formati da due o più atomi. Sono rari, i più abbondanti sono i cosiddetti cationi omopoliatomici che sono quelli che ne contengono più di uno atomo dello stesso elemento, nel caso dello ione triidrogeno, è una delle molecole più abbondanti nel universo. I cationi poliatomici formati da atomi di elementi diversi non sono comuni ma sono caratterizzati da la presenza di idrogeno e si considera originato quando un composto basico cattura un protone (H+).
Esempi:
- Catione ammonio: NH4+
- Catone di ossonio: HO3+
- catione fosfonio: PH3+
- Catone triidrogeno o idrogeno molecolare protonato: H3+
- Dimercurio catione: Hg2+2
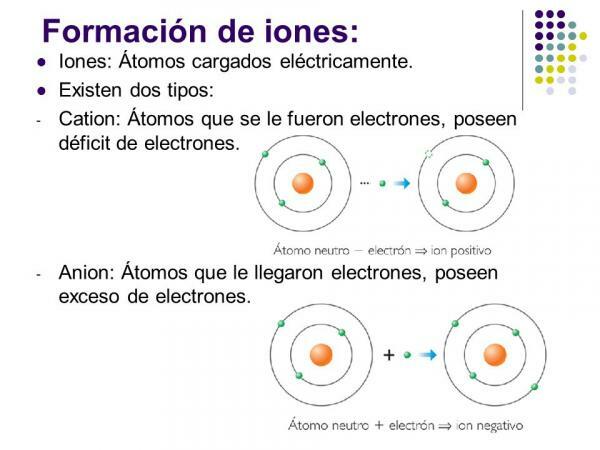
Immagine: Pianeti
Se vuoi leggere più articoli simili a Ioni negativi e positivi: definizione ed esempi, ti consigliamo di entrare nella nostra categoria di l'atomo.
Bibliografia
Alejandrina Gallego Picó, Rosa Mª Garcinuño Martínez, Mª José Morcillo Ortega, Miguel Ángel Vázquez Segura. (2018) Chimica di base. Madrid: Uned
