Struttura e caratteristiche dell'atomo

Immagine: SlidePlayer
Gli atomi fanno parte del nostro mondo. Tutta la materia è fatta di atomi, quindi è importante capire meglio in cosa consistono e quali sono le loro funzioni. In questa lezione di un INSEGNANTE ti diremo cosa struttura di un atomo e caratteristiche. Se vuoi saperne di più sulle particelle che compongono tutta la materia, continua a leggere questo articolo.
Indice
- Cosa sono gli atomi?
- Struttura dell'atomo
- Caratteristiche principali dell'atomo
- Cosa sono gli isotopi?
- Come si trovano gli atomi in natura?
Cosa sono gli atomi?
Il atomo è la più piccola unità in cui la materia può essere divisa senza perdere le sue proprietà chimiche, cioè le sue proprietà come elemento chimico. L'atomo è l'origine di tutto ciò che si può vedere o toccare, dalle stelle alla colazione di stamattina.
Se mettiamo da parte la perdita delle sue proprietà chimiche, possiamo dire che l'atomo è composto da diverse particelle, dette particelle subatomiche. Esistono tre tipi di particelle subatomiche -protoni, neutroni ed elettroni- con caratteristiche diverse.
Queste particelle sono raggruppate in numero diverso per formare gli elementi chimici (ossigeno, carbonio, ecc.), ma saranno sempre distribuite secondo una struttura fissa.

Immagine: Google Sites
Struttura dell'atomo.
La struttura dell'atomo è fissa, cioè possiamo avere diversi tipi di atomi (l'atomo di idrogeno, l'atomo di ossigeno, ecc.) ma le loro particelle subatomiche sono sempre organizzate in modo simile a un sistema planetario.
Ricorderete sicuramente come è organizzato il sistema solare: il Sole è al centro e intorno da questa ruotano i pianeti descrivendo orbite diverse, alcune più vicine ed altre più lontane dal Sole. Nel caso degli atomi, al centro c'è il nucleo, dalla forma simile a una mora ed è composto dal neutroni e il protoni.
Intorno al nucleo c'è il Corteccia che è l'area attraverso la quale elettroni. In precedenza si pensava che gli elettroni descrivessero certe orbite, in modo simile a come fanno i pianeti, anche se ora lo è sa che queste orbite non sono così ben definite e sono più simili ad aree in cui è più probabile che ci troviamo elettroni.
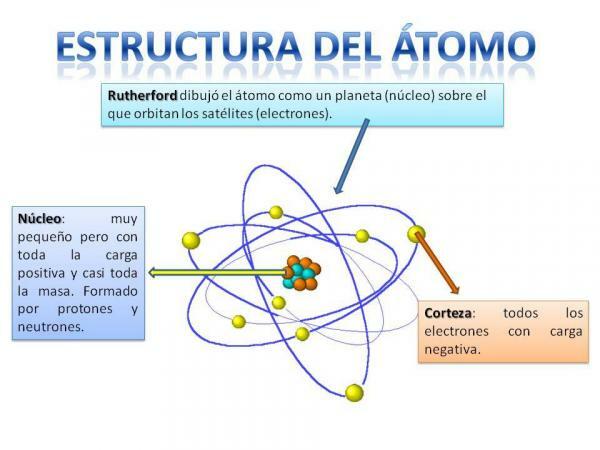
Immagine: REA - Plan Ceibal
Principali caratteristiche dell'atomo.
Per proseguire con questa lezione sulla struttura dell'atomo e le sue caratteristiche, è importante soffermarsi sugli elementi che fanno considerare un atomo come tale.
E per questo dobbiamo rispondere a questa domanda: perché tutti gli atomi decidono di ordinarsi in quel certo modo? La risposta è semplice: è dovuto a forze attrattive elettriche. Il nucleo dell'atomo è formato da neutroni, che non hanno carica elettrica, e protoni, che hanno una carica elettrica positiva. e gli elettroni hanno una carica elettrica negativa, quindi c'è una forza di attrazione simile tra il nucleo e gli elettroni prodotto tra i due poli di un magnete ma non è abbastanza forte da far "cadere" gli elettroni verso il nucleo.
Questo si comprende meglio se teniamo conto del dimensione del nucleo: se l'atomo avesse, ad esempio, la dimensione di uno stadio di calcio, il nucleo avrebbe la dimensione della palla al centro dal campo Quanta forza di attrazione dovrebbe fare il pallone da calcio per far cadere le gradinate dello stadio!
La funzione dei neutroni
Ora ti starai chiedendo, e quale ruolo giocano i neutroni? Pur non avendo una carica elettrica, i neutroni hanno un grande ruolo all'interno dell'atomo: contribuiscono al 99% della massa. Se ti aiuta a ricordare, possiamo dire che un atomo è come una banda di tre amici: i pesanti neutrone, il protone positivo e l'elettrone negativo, che gira intorno al neutrone e elettrone.
Il movimento degli elettroni
A questo punto voglio che torniamo a qualcosa che avevamo lasciato nel calamaio: le orbite che gli elettroni descrivono attorno al nucleo. Lo avevamo detto gli elettroni ruotano intorno al nucleo come fanno i pianeti intorno al Sole, alcuni più vicini di altri, perché lo fanno? Gli elettroni ruotano in un guscio o nell'altro a seconda dell'energia che hanno per allontanarsi dal nucleo, cioè quegli elettroni che sono più vicini al nucleo non hanno la forza sufficiente per allontanarsi dal nucleo mentre quelli negli strati più esterni (orbitali) della crosta hanno più energia e sono stati in grado di allontanarsi ulteriormente dal nucleo. nucleo. Inoltre, in ciascuno degli orbitali c'è una capacità massima di 8 elettroni (regola dell'ottetto).
Le particelle di un atomo
Torneremo su un altro approccio che abbiamo fatto in precedenza ma che non abbiamo spiegato: gli atomi sono costituiti da neutroni, protoni ed elettroni, che si combinano sempre seguendo la stessa struttura di nucleo e crosta, ma lo fanno in numero diverso per formare i diversi elementi chimici. Come possiamo ottenere così tanti elementi combinando solo 3 tipi di particelle? Gli elementi chimici, che tu abbia mai visto rappresentati nella tavola periodica, sono caratterizzati dall'avere un certo numero atomico.
Il numero atomico (Z) Ci dice il numero di protoni nel nucleo di questo tipo di atomo, che è uguale al numero di elettroni in condizioni normali. Così, per esempio, tutti gli atomi che hanno 6 protoni (Z = 6) saranno atomi di carbonio e avranno le stesse proprietà chimiche; gli atomi con 5 protoni (Z = 5) saranno atomi di boro, con le stesse proprietà chimiche tra loro e diverse da quelle degli atomi di carbonio. Non devi confondere il numero atomico con il peso atomico o numero di massa (A), che è la somma del peso dei neutroni e dei protoni (il peso degli elettroni è trascurabile rispetto al peso del nucleo totale).

Immagine: SlidePlayer
Cosa sono gli isotopi?
In natura possiamo trovare diversi "sottotipi" di elementi, i isotopi. Sono sicuro che a un certo punto avrete sentito parlare del carbonio 14, un isotopo radioattivo del carbonio che viene utilizzato per determinare, tra l'altro, l'età dei fossili. Gli isotopi sono due atomi con lo stesso numero di protoni (stesso numero atomico), ma diverso numero di neutroni, (diversa massa atomica). Gli isotopi dello stesso elemento sono solitamente denominati con il nome dell'elemento seguito dalla sua massa atomica.
Nel nostro esempio, entrambi gli isotopi sono carbonio, quindi hanno numero atomico 6 (Z = 6) ma) il carbonio 12 (carbonio “normale”) ha un peso atomico di 12 rispetto al peso atomico del carbonio 14 14. Gli isotopi dello stesso elemento hanno proprietà chimiche e fisiche molto simili. Nel caso del carbonio 14, a differenza del carbonio 12, è un isotopo radioattivo presente in tutti gli elementi che contengono carbonio, compresi gli esseri viventi.
E con questo concludiamo questa lezione sulla struttura dell'atomo e le sue caratteristiche. Speriamo che ti sia stato d'aiuto.

Immagine: i tuoi compiti
Come si trovano gli atomi in natura?
Gli atomi si possono trovare isolati, ma la cosa più normale è trovarli combinati in gruppi chiamato molecole.
Le molecole possono essere costituite da atomi dello stesso elemento (come la molecola di ossigeno, costituita da due atomi di ossigeno) o per gruppi con atomi di elementi diversi (due atomi di idrogeno e uno di ossigeno formano la molecola di Acqua). Questi gruppi di elementi sono chiamati molecole, che a loro volta possono essere combinati tra loro e formando diversi raggruppamenti sempre più complessi a seconda della loro reattività e della loro affinità chimica per fonte di collegamenti chimici.
Se vuoi leggere più articoli simili a Struttura e caratteristiche dell'atomo, ti consigliamo di entrare nella nostra categoria di l'atomo.



