I 10 tipi di legami chimici (spiegati con esempi)
I legami chimici sono i forze che tengono insieme gli atomi per formare le molecole. Esistono tre tipi di legami tra gli atomi:
- Legame metallico.
- Legame ionico.
- Legame covalente: apolare, polare, semplice, doppio, triplo, dativo.
Grazie a questi legami si formano tutti i composti che esistono in natura. Ci sono anche forze che tengono insieme le molecole, note come legami intermolecolari, come:
- Legami o ponti a idrogeno.
- Forze dipolo-dipolo.
Successivamente, spieghiamo ciascuno di questi collegamenti.
| Tipi di legame chimico | Caratteristica | Esempi | |
|---|---|---|---|
| Metallo | Gli ioni metallici galleggiano in un mare di elettroni in movimento. | Elementi metallici: sodio, bario, argento, ferro, rame. | |
| Ionico | Trasferimento di elettroni da un atomo all'altro. | Na sodio cloruro+Cl- | |
| covalente | Non polare | Condividi equamente gli elettroni tra due atomi. | Idrogeno molecolare H-H o H2 |
| Polare | Condividi gli elettroni in modo non uniforme tra due atomi. | Molecola d'acqua H2O | |
| Semplice | Condividi una coppia di elettroni. | Molecola di cloro Cl2 Cl-Cl | |
| Doppio | Condividi due coppie di elettroni. | Molecola di ossigeno O2 O = O | |
| Triplicare | Condividi tre coppie di elettroni. | Molecola di azoto N≣N o N2 | |
| Dativo | Solo uno degli atomi condivide gli elettroni. | Legame tra azoto e boro nel composto trifluoruro di ammoniaca-boro. | |
| Forze intermolecolari | Ponte a idrogeno | Gli idrogeni di una molecola sono attratti dagli atomi elettronegativi di un'altra molecola. | Legami idrogeno tra l'idrogeno in una molecola d'acqua con l'ossigeno in un'altra molecola d'acqua. |
| dipolo-dipolo | Le molecole con due poli elettrici attraggono i poli opposti di altre molecole. | Interazioni tra molecole di H metanale2C = O |
legame metallico Metallic
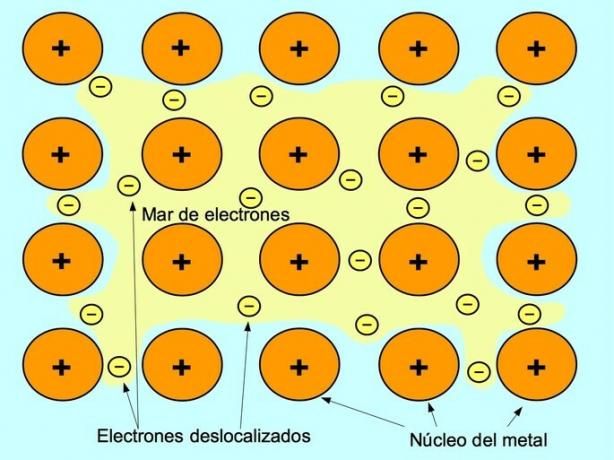
Il legame metallico è la forza di attrazione tra gli ioni positivi degli elementi metallici e gli elettroni negativi che si muovono liberamente tra gli ioni. Gli atomi di metallo sono strettamente impacchettati, questo consente agli elettroni di muoversi all'interno del reticolo degli atomi.
Nei metalli, gli elettroni di valenza vengono rilasciati dal loro atomo originale e formano un "mare" di elettroni che galleggia attorno all'intera struttura metallica. Ciò fa sì che gli atomi di metallo si trasformino in ioni metallici carichi positivamente che si impacchettano insieme.
Il legame metallico si stabilisce tra elementi metallici come sodio Na, bario Ba, calcio Ca, magnesio Mg, oro Au, argento Ag e alluminio Al.
Legame ionico
Il legame ionico è la forza che unisce un elemento metallico, come il sodio o il magnesio, con un elemento non metallico, come il cloro o lo zolfo. Il metallo perde elettroni e si trasforma in uno ione metallico positivo chiamato cazione. Questi elettroni passano all'elemento non metallico e si trasforma in uno ione caricato negativamente chiamato anione.
I cationi e gli anioni si combinano e formano una rete tridimensionale che viene mantenuta dalle forze di attrazione elettrostatica tra gli ioni con cariche diverse. Queste forze formano composti ionici.
La crosta terrestre è costituita principalmente da composti ionici. La maggior parte delle rocce, dei minerali e delle pietre preziose sono composti ionici. Per esempio:
- Cloruro di sodio NaCl: l'elemento metallico è il sodio che cede un elettrone al cloro, che è l'elemento non metallico.
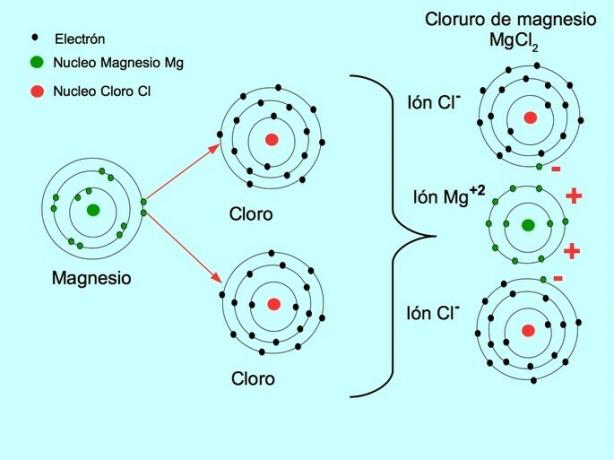
- Cloruro di magnesio MgCl2: Il magnesio Mg dona due elettroni a due atomi di cloro, come mostrato nella figura seguente:
Guarda anche Differenza tra cationi e anioni.
Legame covalente
Il legame covalente si forma quando due atomi non metallici condividono gli elettroni. Questo legame può essere di diversi tipi a seconda dell'affinità per gli elettroni degli atomi e della quantità di elettroni condivisi.
Legame covalente non polare
Il legame covalente non polare è il legame che si forma tra due atomi in cui gli elettroni sono condivisi equamente. Questo legame si verifica normalmente in molecole simmetriche, cioè molecole costituite da due atomi uguali, come la molecola di idrogeno H2 e la molecola di ossigeno O2.

Legame covalente polare
Il legame covalente polare si forma quando due atomi condividono gli elettroni ma uno di essi ha una maggiore attrazione per gli elettroni. Questo fa sì che la molecola abbia un "polo" più negativo con più elettroni e il polo opposto è più positivo.
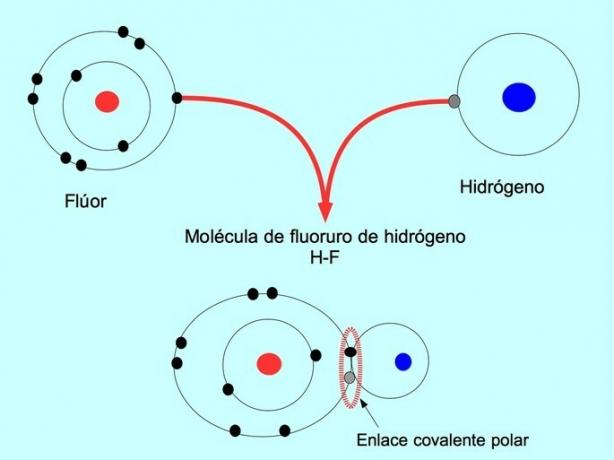
Le molecole con questa distribuzione o squilibrio di elettroni sono note come polari. Ad esempio, nell'acido fluoridrico HF, esiste un legame covalente tra idrogeno e fluoro, ma il fluoro ha una maggiore elettronegatività, quindi attrae più fortemente gli elettroni condivisa.
Legame covalente semplice
Quando due atomi condividono due elettroni, uno da ciascuno, il legame covalente formato è chiamato singolo legame covalente.
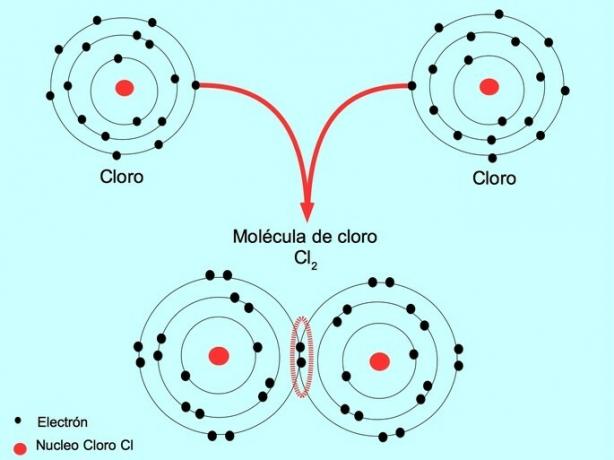
Ad esempio, il cloro è un atomo che ha sette elettroni di valenza nel suo guscio esterno, che può essere riempito con otto elettroni. Un cloro può combinarsi con un altro cloro per formare la molecola di cloro Cl2 che è molto più stabile del solo cloro.
Doppio legame covalente
Il doppio legame covalente è il legame in cui quattro elettroni (due coppie) di elettroni sono condivisi tra due atomi. Ad esempio, l'ossigeno ha 6 elettroni nel suo ultimo guscio. Quando due ossigeni vengono combinati, quattro elettroni vengono condivisi tra i due, facendo sì che ciascuno abbia 8 elettroni nell'ultimo guscio.
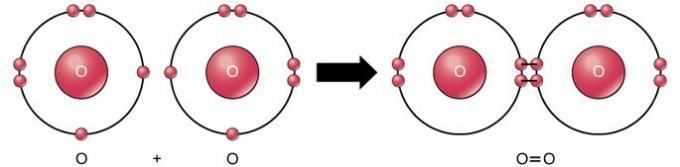
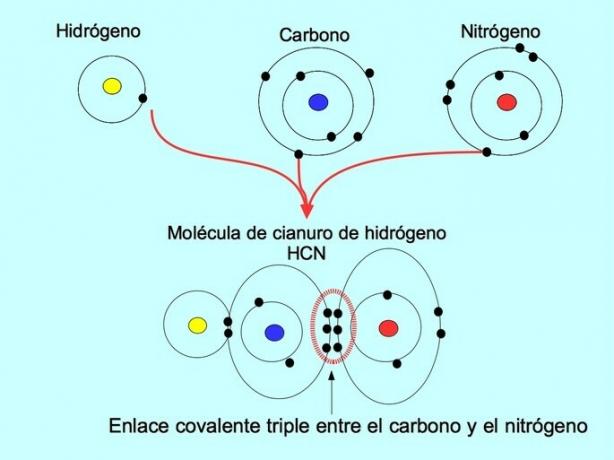
Triplo legame covalente
Il triplo legame covalente si forma quando 6 elettroni (o tre coppie) sono condivisi tra due atomi. Ad esempio, nella molecola di acido cianidrico HCN, si forma un triplo legame tra carbonio e azoto, come mostrato nella figura seguente:
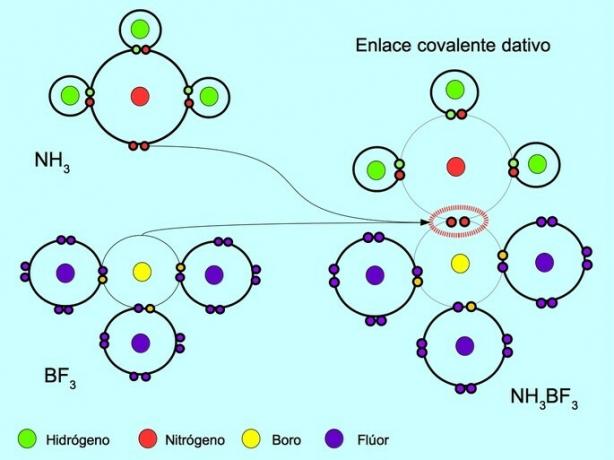
Legame covalente coordinato o dativo
Il legame covalente coordinato o dativo è il legame che si forma quando solo uno degli atomi nel legame contribuisce con una coppia di elettroni. Ad esempio, quando l'ammoniaca NH reagisce3 con trifluoruro di boro BF3, L'azoto si lega con due elettroni direttamente al boro, che non ha elettroni disponibili da condividere. In questo modo, sia l'azoto che il boro rimangono con 8 elettroni nel loro guscio di valenza.
Guarda anche Composti organici e inorganici.
Collegamenti intermolecolari
Le molecole si associano attraverso forze che consentono di formare sostanze allo stato liquido o solido.
Legami o forze dipolo-dipolo
Si possono stabilire legami intermolecolari deboli tra le molecole polari quando i poli negativi sono attratti dai poli positivi e viceversa. Ad esempio, metanale H2C = O è una molecola polare, con una parziale carica negativa sull'ossigeno e una parziale carica positiva sugli idrogeni. Il lato positivo di una molecola metanale attrae il lato negativo di un'altra molecola metanale.
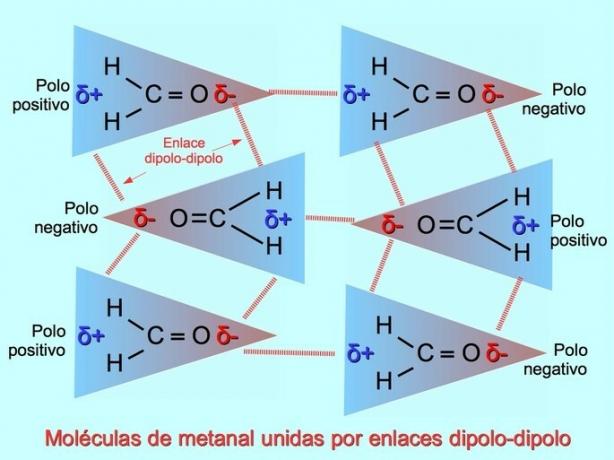
Legami a idrogeno o legami
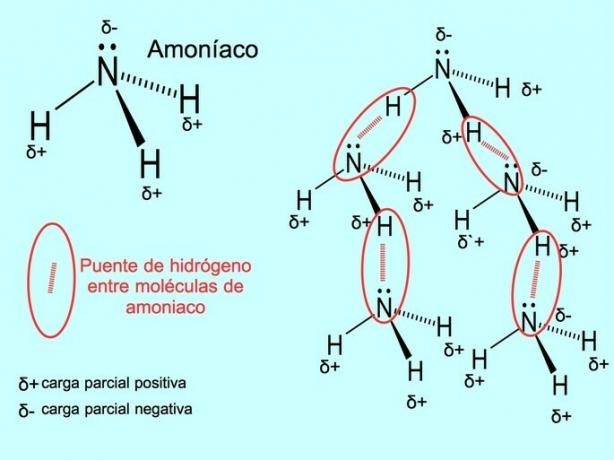
Il legame idrogeno o legame idrogeno è un legame che si stabilisce tra le molecole. Si verifica quando un idrogeno nella molecola è legato covalentemente a un ossigeno, un azoto o un fluoro. Ossigeno, azoto e fluoro sono atomi con maggiore elettronegatività, quindi attraggono più fortemente gli elettroni quando li condividono con un altro atomo meno elettronegativo.
Esistono legami idrogeno tra le molecole d'acqua H2O e ammoniaca NH3 come mostra l'immagine:
Potresti essere interessato a vedere:
- Atomi e molecole.
- Esempi di composti organici e inorganici.
- Metalli e non metalli
Riferimenti
Zumdahl, S.S., Zumdahl, S.A. (2014) Chimica. Nona edizione. Brooks/Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chimica 1. 5a edizione. Pearson Australia. Melbourne.


