Caratteristiche di acidi e basi: principali differenze
Le caratteristiche degli acidi e delle basi sono tutte quelle proprietà e qualità con cui possiamo distinguere tra un acido e una base.
Secondo la teoria di Arrehnius, a acido è una sostanza che rilascia protoni H+ quando sciolto in acqua, e a base è qualsiasi sostanza che rilascia ioni ossidrile OH- quando in soluzione acquosa.
| Acidi | basi | |
|---|---|---|
| Formazione di ioni | Presente | Presente |
| Reazione di neutralizzazione | Quando reagisce con una base. | Quando reagisce con un acido. |
| Solubilità dell'acqua | Solubile | Parzialmente solubile. Gli idrossidi di calcio, bario e alluminio sono scarsamente solubili. |
| Conducibilità elettrica | Presente | Presente |
| Stato della materia | Solido, liquido o gassoso | Solido, liquido o gassoso |
| Reazione con cartina di tornasole | Colorazione rossa | Colorazione blu |
| valore del ph | Meno di 7 | Maggiore di 7 |
| Controparte coniugata | Un acido debole forma una base coniugata. | Una base debole forma un acido coniugato. |
| Effetto corrosivo | Acidi forti | basi forti |
Caratteristiche degli acidi
Gli acidi hanno diverse caratteristiche con cui possono essere identificati.
Capacità di formare ioni dagli acidi
La caratteristica principale delle sostanze acide è che possono essere ionizzate, cioè perdere o guadagnare elettroni.
L'acido cloridrico HCl, un acido forte, ionizza per formare l'anione cloruro Cl- e protone H+.
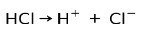
Reazione di neutralizzazione
Un acido reagisce con una base per formare un sale e acqua. Questa reazione è nota come reazione di neutralizzazione. Ad esempio, HCl reagisce con NaOH per formare cloruro di sodio NaCl (sale da cucina) e acqua:
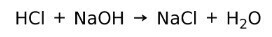
Idrosolubilità degli acidi
Gli acidi sono generalmente solubili in acqua. Ad esempio, l'acido cloridrico o l'acido muriatico è moderatamente solubile in acqua, fino a 82 g di HCl possono essere sciolti in 100 ml di acqua a 0ºC. Nel caso dell'acido solforico H2SW4, la miscela con l'acqua genera calore, quindi è sempre consigliabile aggiungere l'acido all'acqua per evitare esplosioni.
Forza acida
Il modo in cui gli acidi si dissociano determina se sono forti o deboli. La forza di un acido è data dalla sua Costante di dissociazione.
Acido nitrico HNO3 è un acido forte perché in soluzione acquosa si ionizza completamente in protoni e ioni nitrato:

Ciò significa che quando aggiungiamo HNO3 in acqua, analizzando l'acqua troveremo solo H+ e ioni nitrato, e praticamente nessun HNO3.
Invece, l'acido acetico trovato nell'aceto è un is acido debole, perché solo una parte di esso è dissociata:
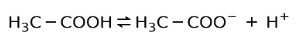
Ecco perché è rappresentato con frecce in due direzioni, questo significa che in soluzione acquosa avremo acido acetico, H+ e l'anione acetato (H3C-COO-).
Stati della materia degli acidi
Gli acidi si possono trovare allo stato liquido, solido o gassoso. Ad esempio, l'acido cloridrico HCl è liquido, l'idrogeno solforato HS è un gas e l'acido ossalico è un solido.
Reazione con cartina di tornasole da acidi

Quando mettiamo una striscia di cartina di tornasole in una sostanza acida, la cartina di tornasole diventa rossa.
Identificazione degli acidi in base al loro pH
PH è la misura della quantità di H+ presente in una soluzione. Quindi, tra pH 0 e 7, siamo in presenza di un acido. Ad esempio, l'aceto ha un pH pari a 2, il pH dell'acido solforico nelle batterie delle auto è pari a 1.
Conducibilità elettrica degli acidi
Poiché gli acidi possono dissociarsi e produrre ioni caricati elettricamente, le soluzioni acide possono condurre elettricità. Ad esempio, all'interno delle batterie delle auto, l'acido solforico, che è un acido forte, viene utilizzato come conduttore di elettricità.
Effetto corrosivo degli acidi forti
Gli acidi forti hanno un effetto corrosivo, possono bruciare i tessuti organici quindi la loro manipolazione deve essere estremamente attenta.
Gli acidi deboli formano una controparte coniugata
Quando disciolti, gli acidi deboli formano quella che è nota come coppia coniugata, cioè un acido debole forma una base coniugata.
Per esempio:

In questo caso, l'acido formico o metanoico (HCOOH), quando dissociato, forma il formato di ioni base coniugato.
Potrebbe interessarti:
- Acidi e basi forti e deboli.
- Esempi di acidi e basi.
Caratteristiche delle basi
Di seguito presentiamo le proprietà delle basi o soluzioni alcaline che le caratterizzano.
Capacità di ionizzazione di base
Le sostanze basiche o alcaline sono caratterizzate dalla formazione di ioni quando disciolte in acqua:

In questo caso, l'idrossido di sodio NaOH si ionizza per formare un anione idrossido OH- e un catione di sodio Na+.
Una base reagisce con un acido per formare un sale
Una base reagisce con un acido in una reazione di neutralizzazione per formare acqua e un sale, ad esempio:

In questo caso, l'idrossido di alluminio Al (OH)3, una base, reagisce con HCl e forma il sale di cloruro di alluminio AlCl3 e acqua. L'idrossido di alluminio viene utilizzato come antiacido per alleviare il reflusso gastrico neutralizzando l'acido prodotto dallo stomaco.
Basi solubilità in acqua
Alcune basi sono solubili in acqua. Gli idrossidi alcalino terrosi, come l'idrossido di calcio e l'idrossido di bario, sono scarsamente solubili in acqua. Ad esempio, l'idrossido di sodio o la soda caustica possono essere sciolti 109 g in 100 ml di acqua a 20ºC. Mentre idrossido di magnesio o latte di magnesia Mg (OH)2 è praticamente insolubile in acqua.
Forza di base
A seconda del grado di ionizzazione della base, questi possono essere forti o deboli. Ad esempio, l'idrossido di litio è a base forte perché in soluzione acquosa si ionizza completamente in ioni idrossido OH e cationi Litio+:
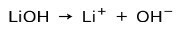
Al contrario, l'ammoniaca NH3 è un base debole perchè a contatto con l'acqua non tutta l'ammoniaca si dissocia:
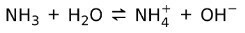
Stato della materia delle basi
Le basi si possono trovare allo stato solido, liquido e gassoso. Ad esempio, l'idrossido di sodio puro è solido, l'ammoniaca è un gas.
Reazione con la cartina di tornasole delle basi
Quando mettiamo una striscia di cartina tornasole in una sostanza alcalina, la carta diventa blu.
Identificazione delle basi in base al loro pH
Le basi sono caratterizzate dall'avere un pH compreso tra 7 e 14.
 Conducibilità elettrica delle basi
Conducibilità elettrica delle basi
Le basi per la loro capacità di ionizzazione sono buoni conduttori di elettricità. Ad esempio, nelle batterie alcaline, l'idrossido di potassio KOH viene utilizzato come conduttore elettrico.
Effetto corrosivo delle basi
Le basi forti possono danneggiare i tessuti organici. Ad esempio, i detergenti per forni da cucina sono generalmente basi resistenti, ed è sempre consigliato maneggiarli con estrema cura, indossando guanti e protezioni per gli occhi.
Le basi deboli formano una controparte coniugata
Le basi deboli quando disciolte formano una controparte coniugata, cioè una base debole forma un acido coniugato.
Ad esempio, tris- (idrossimetil) ammino metano (OHCH2)3CNH2 è una base debole il cui acido coniugato è (OHCH2)3CNH3+:
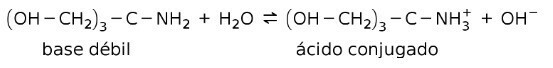
Questa è la base per l'azione delle sostanze tampone o buffer, che sono sostanze che servono a mantenere costantemente il pH delle soluzioni.
Potresti essere interessato a conoscere le differenze tra:
- Acidi e basi.
- Cationi e anioni