I 10 tipi di elementi chimici (spiegati e classificati)
Quanti elementi chimici devono esistere nell'universo? Questa domanda ha ancora molta strada da fare, dal momento che gli scienziati di tanto in tanto creano i propri elementi chimici artificiali.
Tuttavia, ciò a cui possiamo rispondere è quanti tipi di elementi chimici devono esistere, qualcosa che scopriremo in seguito.
- Articolo correlato: "Gli 11 tipi di reazioni chimiche"
I tipi di elementi chimici
In natura possiamo trovare tutti i tipi di sostanze. Queste sostanze non si trovano solitamente allo stato puro, ma sono il risultato della combinazione di diversi elementi o materiali che attraverso diverse reazioni, processi e periodi di tempo hanno dato origine a tutti i tipi di questione. Non c'è niente nell'universo che non sia il risultato della combinazione di atomi appartenenti a diversi tipi di elementi chimici, che vedremo in dettaglio.
Tuttavia, prima di esaminare i tipi di elementi chimici, facciamo un piccolo ripasso delle scienze delle scuole superiori e ricordiamo cosa sono gli elementi chimici.
Chiamiamo "elemento chimico" la materia composta dallo stesso tipo di atomo, cioè una sostanza atomicamente pura. Gli elementi chimici non possono essere scomposti in elementi più semplici e sono classificati nella tavola periodica degli elementi come materiali puri dell'universo.
Ma attenzione! Non bisogna confondere gli elementi con le sostanze semplici, poiché in certi casi due o più atomi dello stesso elemento possono comporre molecole raggruppate in modi diversi che fanno variare alcune delle proprietà fisiche dell'elemento in questione, questi casi essendo i isotopi. Ad esempio, diamante e carbonio sono sostanze costituite dall'elemento chimico carbonio (C). ma che è organizzato in modi diversi e si traduce in due materiali completamente diversi.
Carl sagan Diceva che siamo polvere di stelle che si riflette sulle stelle. Questa bella frase non è una semplice metafora, ma un fatto scientifico. Gli elementi chimici si formano, per quanto ne sappiamo, all'interno delle stelle essendo il risultato di complessi processi di fusione e fissione atomica che generano elementi sempre più pesanti, risultato di un processo chiamato nucleosintesi.
La maggior parte degli elementi conosciuti può essere ottenuta dalla natura, trovato spontaneamente o formando composti con altri elementi come uranio (U), carbonio (C), silicio (Si), argento (Ag) o oro (Au). Altri, invece, sono stati fabbricati in laboratori come l'americio (Am), il berkelio (Bk) o il curio (Cm). Qualunque sia il suo metodo per ottenerlo o se è presente in natura, a seconda delle sue proprietà, l'elemento chimico in questione avrà alcuni usi o altri.
Al momento sono noti circa 118 elementi chimici, anche se, tenendo conto che gli esseri umani sono stati in grado di fabbricare nuovi elementi, è questione di tempo prima che la tavola periodica si espanda.
- Potresti essere interessato a: "I 2 tipi di elettricità (spiegati)"
I principali tipi di elementi chimici
I principali tipi di elementi chimici sono rappresentati nella tavola periodica, un sistema di classificazione creata dal chimico russo Dmitri Mendeleev (1834-1907) che ne pose le basi in 1869. Gli elementi chimici sono ordinati visivamente in base alle loro proprietà e caratteristiche.
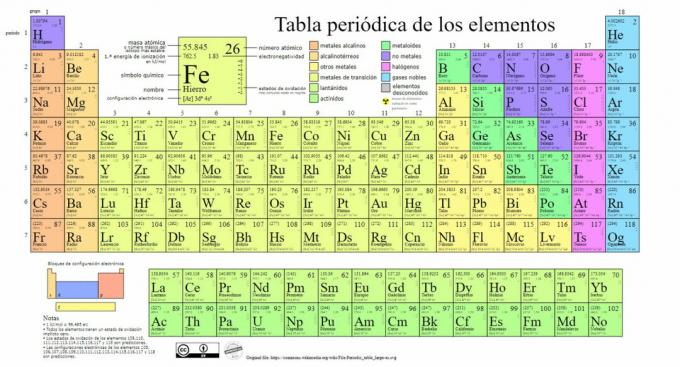
Nel tempo e man mano che la chimica faceva importanti scoperte scientifiche, questa tabella sarebbe stata ampliata consecutivamente, raggiungendo la forma che ha oggi con i 118 elementi finora conosciuti.
Attualmente, in questa tabella possiamo trovare i seguenti tipi di elementi chimici:
1. Metalli
I metalli sono elementi chimici che generalmente contengono da uno a tre elettroni nell'ultima orbita del loro atomo, elettroni che possono essere facilmente trasferiti rendendoli conduttori di calore ed elettricità.
I metalli sono generalmente malleabili e duttili, con una caratteristica lucentezza la cui intensità dipende dal movimento degli elettroni che compongono i loro atomi. Il più delle volte, i metalli sono solidi a temperatura ambiente, ad eccezione del mercurio.
Tra i metalli troviamo l'oro (Au), l'argento (Ag), il rame (Cu) e l'alluminio (Al) le cui caratteristiche fisiche li rendono magnifici conduttori di elettricità, sebbene la loro presenza in natura sia molto varia, riflessa nella differenza tra i loro pesi.
Si ritiene che il 75% degli elementi chimici esistenti in natura siano metalli, mentre il restante 25% sarebbe costituito da gas nobili, metalloidi e altri tipi.
Ci sono classificazioni all'interno di questa categoria, trovando attinidi, lantanidi, metalli di transizione, metalli alcalini, metalli alcalino-terrosi e altri metalli.
- Articolo correlato: "10 cibi ricchi di zinco"
1.1. lantanidi
Gli elementi lantanidi si trovano in depositi costituiti da molti minerali. Sono metalli bianchi che si ossidano facilmente a contatto con l'aria. Tra questi troviamo il Lantanio (La), il Promezio (Pm), l'Europio (Eu) e l'Itterbio (Yb).

- Potresti essere interessato a: "I 5 tipi di legami chimici: ecco come è composta la materia"
1.2. attinidi
Tutti gli isotopi degli attinidi sono radioattivi. Tra questi troviamo attinio (Ac), uranio (U), plutonio (Pu) ed einsteinio (Es).
1.3. Metalli di transizione
I metalli di transizione si trovano nella parte centrale del sistema periodico. La sua caratteristica principale è che hanno configurazione elettronica dell'orbitale "d" parzialmente riempito di elettroni.
In questo gruppo ci sono sostanze di ogni genere e, secondo la sua classificazione più ampia, corrisponderebbe agli elementi chimici da 21 a 30, da 39 a 48, da 71 a 80 e da 103 a 112, per un totale di quaranta e tra questi troveremmo vanadio (V), rutenio (Ru), argento (Ag), tantalio (Ta) e lawrencio (Lr).

1.4. Metalli alcalini
I metalli alcalini sono un gruppo di sei elementi composto da litio (Li), sodio (Na), potassio (K), rubidio (Rb), cesio (Cs) e francio (Fr). Sono metalli lucidi e teneri, altamente reattivi a temperatura e pressione normali e perdono facilmente il loro elettrone esterno, situato nel loro orbitale "s".
1.5. Terre alcaline
I metalli alcalino terrosi sono un gruppo di elementi in cui troviamo berillio (Be), magnesio (Mg), calcio (Ca), stronzio (Sr), bario (Ba) e radio (Ra). Il suo nome deriva dal nome dato ai suoi ossidi, "terre", che hanno proprietà basiche o alcaline.
Terre alcaline sono più dure di quelle alcaline, brillano e sono buoni conduttori elettrici. Sono meno reattivi di quelli alcalini e agiscono come buoni agenti riducenti. Hanno la capacità di formare composti ionici e hanno tutti due elettroni nel loro guscio più esterno.

1.6. Altri metalli
La categoria "altri metalli" è un tipo di sostanze che si trovano qui perché non si sa bene dove metterle.
Sono elementi metallici situati nella tavola periodica insieme ai metalloidi, all'interno del blocco p. Tendono ad essere morbidi con punti di fusione bassi. Tra questi ci sono alluminio (Al), indio (In), stagno (Sn) e bismuto (Bi) tra gli altri.

2. Nessun metallo
I non metalli generalmente possiedono tra cinque e sette elettroni nella loro ultima orbita, una proprietà che rende che guadagnano elettroni invece di cederli e, così, riescono ad avere otto elettroni che così li stabilizzano come atomi.
Questo elementi sono pessimi conduttori di calore ed elettricità. Inoltre non hanno una lucentezza caratteristica, sono poco malleabili, poco duttili e molto fragili allo stato solido. Non possono essere arrotolati o allungati, a differenza dei metalli.
Sono per lo più essenziali per i sistemi biologici, poiché sono presenti nel composti organici, come zolfo (S), carbonio (C), ossigeno (O), idrogeno (H) e iodio (I).

- Articolo correlato: "I 20 tipi di pietre preziose (descritte e con immagini)"
3. metalloidi
Come suggerisce il nome, i metalloidi sono una classificazione intermedia tra metalli e non metalli che hanno proprietà di entrambi i gruppi. Ciò è dovuto al fatto che hanno quattro atomi nella loro ultima orbita, una quantità intermedia a quella dei metalli e dei non metalli.
Questi elementi chimici conducono l'elettricità solo in una direzione, non permettendo che avvenga nella direzione opposta come avviene nei metalli. Un esempio di ciò si trova nel silicio (Si), un metalloide utilizzato nella fabbricazione di elementi semiconduttori per l'industria elettronica grazie a questa proprietà.
Altri metalloidi sono: boro (B), arsenico (As), antimonio (Sb) e polonio (Po).

4. Alogeni
Gli alogeni sono un gruppo di sei elementi che tendono a formare molecole composte da due atomi (biatomici) molto attivi chimicamente per la loro elettronegatività.
Queste sostanze si presentano solitamente sotto forma di ioni, cioè molecole caricate elettricamente, che in questo caso sono mononegative, altamente ossidanti. Ciò significa che gli alogeni sono sostanze caustiche e corrosive.
Gli alogeni sono: fluoro (F), cloro (Cl), bromo (Br), iodio (I), astato (At) e tenese (Ts).

5. gas nobili
I gas nobili sono un gruppo di sette il cui stato naturale è gassoso. Di solito si presentano sotto forma di molecole biatomiche di reattività molto bassa, cioè non reagiscono con altri elementi che compongono altre sostanze e, per questo stesso motivo, sono detti gas inerti. Questo perché nella sua ultima orbita c'è il numero massimo di elettroni possibile per quel livello, otto in totale.
Questo gruppo selezionato di elementi è composto da elio (He), neon (Ne), argon (Ar), krypton (Kr), xeno (Xe), radon (Rn) e oganeson (Og), precedentemente noto come ununoctium.


