Cosa sono le FORMULE CHIMICHE e a cosa servono [RIASSUNTO + VIDEO]
Sebbene non sembri, gli elementi chimici della tavola periodica Ci circondano da tutte le parti. Tuttavia, molte volte non si trovano separatamente, ma piuttosto formano molecole o macromolecole di vari elementi chimici. Le formule chimiche sono l'espressione grafica di questi composti e vengono utilizzate per standardizzare la loro nomenclatura. In questa lezione di un INSEGNANTE vedremo cosa sono le formule chimiche e a cosa servono. Unisciti a noi per saperne di più!
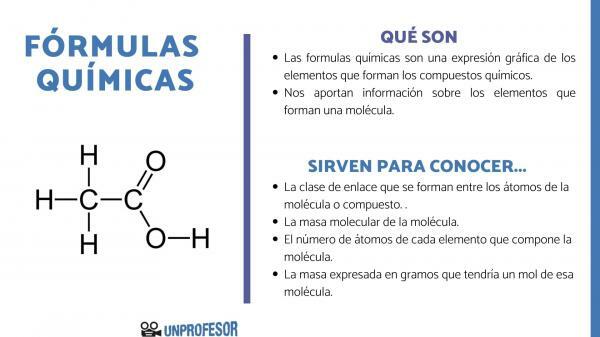
Il formule chimiche sono un'espressione grafica degli elementi che compongono il composti chimici.
Queste formule chimiche non sono arbitrarie, ma ne seguono alcune regole severe della nomenclatura chimica, stabilita dal IUPAC (Unione Internazionale di chimica pura e applicata).
Le formule chimiche ci forniscono anche informazioni sul elementi che compongono una molecola, così, ad esempio, ci dice il numero e le rispettive proporzioni di ciascuno degli atomi che lo compongono e, talvolta, anche il tipo di Legame chimico che esiste tra quegli elementi.
Ogni molecola o macromolecola che esiste corrisponde alla sua formula chimica, tuttavia ci sono diversi tipi di formule. Ognuno di questi tipi ci fornisce informazioni diverse sulla molecola, ma tutti ci aiutano a capirne la natura chimica e ci aiuta a capire cosa succede nelle reazioni chimiche e come un composto può trasformarsi in altri.
Ma per comprendere questa nomenclatura chimica è necessario avere una certa conoscenza in chimica, poiché obbediscono a un linguaggio tecnico abbastanza specializzato.

Immagine: Slideplayer
Il formule chimiche sono rappresentati da unione di simboli chimici, con la lettera corrispondente di ciascun atomo come viene nel tavola periodicae pedici, che sono numeri che rappresentano la quantità di quelli atomi nella molecola
All'interno della chimica (sia organica che inorganica) ci sono alcuni frammenti o composti che mostrano una certa ricorrenza sia strutturale che funzionale e sono identificati da nomi specifica. Quando questi frammenti hanno elettroni liberi che non sono condivisi, sono chiamati radicali e sono composti instabili, altamente reattivi con una breve emivita.
Esempi di radicali sono gruppi metilici CH3, gruppi nitrati NO3, gruppi ossidrile OH- o il radicale Cl-. Tuttavia, sono noti come gruppi funzionali quando sono atomi o gruppi di atomi attaccati a una catena anidride carbonica (con vari tipi di carbonio) e che sono responsabili della reattività e delle proprietà chimiche di molecole.
Questi gruppi sono particolarmente importanti all'interno della chimica organica (le biomolecole umane sono fondamentalmente carbonio e idrogeno). Alcuni esempi di gruppi funzionali sono il gruppo carbonilico = C = O o il gruppo carbossilico -COOH.

Immagine: Monogramas.com
Come abbiamo detto, ci sono diversi tipi di formule chimiche. Ognuna di queste formule ci fornisce un diverso tipo di informazione sulle molecole e, quindi, serve un obiettivo particolare, senza che nessuna formula sia migliore o peggiore di un'altra in termini generali.
Le classi di formule chimiche che distinguiamo sono:
Formule empiriche
Le formule empiriche sono le formule più semplici per rappresentare una molecola chimica, a volte dicendo che sono formule minime. Queste formule rappresentano la proporzione degli atomi di ciascuno degli elementi nella molecola, che sono semplificati a numeri interi, sempre i più piccoli. Un esempio di questa formula è CH3 (gruppo metile), con tre atomi di idrogeno e un atomo di carbonio.
Tuttavia, queste formule a volte possono dare idee sbagliate sulla composizione della molecola. Ciò si verifica quando la formula non indica il numero effettivo di atomi nella molecola, come con il perossido idrogeno, la cui formula empirica è HO quando la formula dovrebbe essere H2O2 (due atomi di idrogeno e due di ossigeno). Ciò avviene quindi attraverso una convenzione di nomenclatura, poiché entrambi i pedici sono uguali, sono semplificati.
Alcuni composti, tuttavia, possono essere rappresentati solo da formule empiriche, poiché sono costituiti da reti di ioni. Ciò si verifica ad esempio nel sale comune o nel cloruro di sodio, che è rappresentato come NaCl, il che indica che per ogni sodio c'è un cloro.
Formule molecolari
Questi tipi di formule sono piuttosto basilari, esprimono semplicemente il tipo di atomi e il numero di ciascuno presente in una molecola covalente. Sono formule che presentano gli elementi chimici e il numero in modo lineare (sotto forma di pedice. Un esempio di questo tipo di formula è quando il glucosio è chiamato C6H12O6, che esprime quel glucosio La molecola di glucosio è composta da sei atomi di carbonio, dodici atomi di idrogeno e sei di ossigeno.
Le formule molecolari sono ampiamente utilizzate, a volte dicendo che sono le vere formule delle molecole. In molti casi coincidono con le formule empiriche, ad esempio in CO2.
Formule semi-sviluppate
Le formule semi-sviluppate sono un tipo di formule simili alle formule molecolari, poiché esprimono anche gli atomi che compongono la molecola e il loro numero, ma anche fornire informazioni sui legami chimici (rappresentati da linee tra gli atomi) e sul tipo di legame tra gli atomi di carbonio che lo formano (se sono semplici, doppi o tripli). La formula semisviluppata è utile per identificare i radicali che compongono la molecola e la sua struttura chimica (non sono rappresentati i legami tra gli atomi di carbonio e di idrogeno).
Nel caso del glucosio la sua formula semisviluppata è CH2OH - CHOH - CHOH - CHOH -CHOH - CHO e come si vede gli atomi di carbonio, idrogeno e ossigeno sono gli stessi della formula molecolare (rispettivamente sei, dodici e sei) e tutti i singoli legami (il glucosio ha solo legami semplice). Questa formula è quindi una formula più complessa della formula molecolare.
Le formule semi-sviluppate sono talvolta chiamate condensate e sono forse la classe di formule più utilizzata. utilizzati, soprattutto in chimica organica, sebbene non permettano di osservare la reale geometria delle molecole.
Formula sviluppata
Le formule sviluppate sono un po' più complesse di quelle semi-sviluppate. In questo tipo di formule, il legame e la posizione di ciascun atomo nella molecola sono rappresentati su un piano cartesiano, fino a rappresentare l'intero composto.
Formula strutturale
La formula di struttura è una rappresentazione grafica della struttura della molecola nello spazio, fornendoci informazioni sull'ordine e la distribuzione degli atomi nello spazio. In questa formula vengono mostrati anche i legami chimici che compongono la molecola e se sono singoli, doppi o tripli. Questa formula è, quindi, quella che ci fornisce più informazioni sulla molecola.
Questi tipi di formule sono maggiormente utilizzate a livello professionale all'interno del mondo della chimica, poiché consentono di vedere molto più chiaramente le reazioni chimiche o la sintesi di nuove molecole.
formule di Lewis
Si tratta di formule complesse, molto specifiche e tecniche. Sono anche conosciuti come diagrammi o strutture di Lewis e sono simili alle formule sviluppate delle molecole, ma Inoltre sono indicati gli elettroni che gli atomi condividono in ciascun legame chimico, che variano con la valenza degli atomi coinvolto.
In queste formule i legami tra gli atomi sono rappresentati da linee (indicando anche se sono singoli, doppi o tripli) o con una coppia di punti. Gli elettroni solitari o gli elettroni che non sono condivisi nel legame, sono rappresentati da punti attorno all'atomo a cui corrisponde.

Immagine: chimica organica
Quando si scrivono formule, a volte si fa riferimento alnumero di ossidazione dell'elemento (è frequente nei composti ionici). Questi sono un insieme di numeri positivi e negativi che vanno associato ad ogni elemento.
- I numeri di ossidazione possono essere interpretati come numero di elettroni che un elemento condivide un legame covalente o si trasferisce in un legame ionico.
- Quando il segno di ossidazione sopra l'atomo è negativo, significa che questo elemento cattura elettroni e il numero che lo accompagna accanto è il numero di elettroni catturati. Pertanto, uno stato di ossidazione di -1 significa che l'elemento preleva un elettrone, -2 che ne preleva due e così via.
- Quando il segno di ossidazione è positivo, l'atomo cede un elettrone e il numero che accompagna questo segno è il numero di elettroni ceduti. Allo stesso modo, uno stato di ossidazione di +1 significa che produce un elettrone, +2 che ne produce due e così via.
Funziona principalmente per composti ionici, nei legami covalenti, sebbene l'interpretazione sia simile, non è la stessa poiché questi legami condividono gli elettroni. In questi composti si parla di elementi più elettronegativi, che attirano maggiormente la coppia elettronica e vengono lasciati con una carica più negativa, a seconda del numero di elettroni che attrae. Questo può essere visto in formule di Lewis.
Se vuoi sapere a cosa servono le formule chimiche, devi considerare che questo numero ci permette di ottenerne qualcuna informazioni sulla molecola, come sono:
- Il collegamento classe che si formano tra gli atomi della molecola o del composto. Questi legami sono normalmente covalenti quando vi partecipano atomi non metallici e ionici se sono legami metallici e non metallici.
- Il massa molecolare della molecola.
- Il numero di atomi di ogni elemento che compone la molecola. A volte è chiamata la composizione centesimale della molecola.
- La massa espressa in grammi che avrebbe una mole di quella molecola.
Nel caso di un composto ionico, ad esempio cloruro di sodio o sale comune, non è strettamente corretto parlare di molecole (anche se a volte si fa), che queste tendono a formare grandi aggregati e macromolecole. In questo caso, la formula del composto ci aiuta a vedere quali ioni lo formano e in quale quantità.



