პერიოდული ცხრილის ევოლუცია: შექმნიდან დღემდე
პერიოდული ცხრილი ერთ-ერთია ყველაზე ხატოვანი ხატები მეცნიერების. მიუხედავად იმისა, რომ 2019 წელი იყო მისი შექმნის 150 წლისთავი, ეს სულაც არ არის დასრულებული დოკუმენტი. მასწავლებლის ამ გაკვეთილზე ვნახავთ რა პერიოდული სისტემის განვითარება მისი შექმნიდან დღემდე და რაც ატომებისა და მათი თვისებების ცოდნის მიღწევებშია შესაძლებელი.
ინდექსი
- რა არის პერიოდული სისტემა?
- პირველი პერიოდული ცხრილი: წარმოშობა
- პერიოდული სისტემის ისტორია და ევოლუცია
რა არის პერიოდული სისტემა?
პერიოდული ცხრილი ელემენტების პერიოდული სისტემა არის სამეცნიერო დოკუმენტი, რომელიც მეტ ინფორმაციას კონცენტრირდება ნაკლებ სივრცეში და წარმოადგენს მეცნიერების ერთ-ერთ ყველაზე ძლიერ ხატს. ის შეიცავს კარგ ნაწილს ქიმიის შესახებ ცოდნა გვაქვს. მსგავსი დოკუმენტი არცერთ სხვა სამეცნიერო დისციპლინაში არ არსებობს.
ელემენტების პერიოდული ცხრილი არის a ქიმიური ელემენტების კლასიფიკაციის სისტემა ეს 200 წელზე მეტი ხნის წინ დაიწყო. ეს კლასიფიკაციის სისტემა დროთა განმავლობაში იზრდებოდა და იცვლებოდა, რადგან მეცნიერება ვითარდებოდა და ახლები აღმოაჩინეს
ქიმიური ელემენტები. ამასთან, მრავალი მოდიფიკაცია განხორციელდა მისი ფუნდამენტური სტრუქტურის უცვლელი შენარჩუნებით.პერიოდულ ცხრილს ასე უწოდებენ გამოხატავს გრაფიკულად გარკვეული გზით, ისინი რეგულარული ინტერვალებით იმეორებენ ქიმიური თვისებები. ეს არის ორგანზომილებიანი წარმოდგენის ტიპი, ან უფრო თანამედროვე გამოსახულებებში, სამგანზომილებიანი.
იმ კლასიკური პერიოდული სისტემა (ორ განზომილებიანი) ქიმიური ელემენტებია განლაგებული ჯგუფები ან ოჯახები და წარმოდგენილია პერიოდულ ცხრილში ვერტიკალური სვეტებით. ამ ჯგუფების სვეტებად განლაგება წარმოშობს მწკრივების სერიას, რომლებსაც პერიოდები ეწოდება, სადაც ელემენტები ატომური წონის მიხედვით არის განლაგებული. პერიოდული ცხრილი შედგება შვიდი პერიოდისაგან, რომელთა სიგრძეც განსხვავდება.

პირველი პერიოდული ცხრილი: წარმოშობა.
მენდელეევამდე სხვა მეცნიერებმა შეიმუშავეს ქიმიური ელემენტების კლასიფიკაციის სისტემები. მაგრამ, ელემენტების პერიოდული სისტემისგან განსხვავებით, ისინი იყვნენ ცნობილი ელემენტების მხოლოდ სიები; ხოლო პერიოდულ ცხრილს აქვს თავისებურება, რომ იგი წარმოადგენს კლასიფიკაციის სისტემას ორ განზომილებაში (მწკრივები) და სვეტები) ან სამი განზომილება, მისი ყველაზე თანამედროვე ვერსიებში, სადაც ქიმიური ელემენტები განლაგებულია თანმიმდევრულად ფენებს.
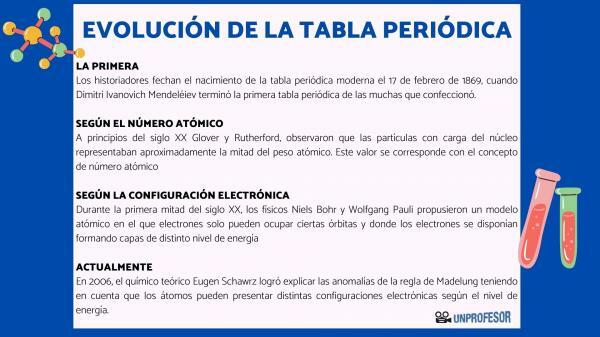
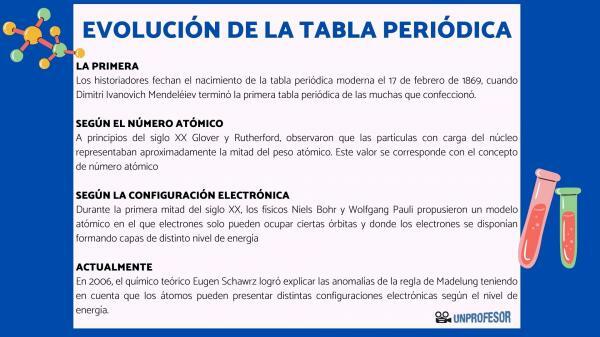
ამ მიზეზის გამო, ისტორიკოსები თარიღდება თანამედროვე პერიოდული ცხრილით 1869 წლის 17 თებერვალი როდესაც დიმიტრი ივანოვიჩ მენდელეევი დასრულება პირველი პერიოდული ცხრილი იმ მრავალთაგან, რაც მან გააკეთა. ეს მაგიდა შედგებოდა ოჯახებში განლაგებული 63 ელემენტისგან და ცარიელი ადგილები დატოვა ელემენტებისათვის, რომლებიც ჯერ არ არის აღმოაჩინეს, მაგრამ საიდანაც მან გამოიტანა მათი ატომური წონა (როგორც გალიუმის, გერმანიუმის და სკანდიუმი)
პერიოდული სისტემის აღმოჩენის ძირითადი მონაცემები იყო წინა ცოდნა ატომური წონა თითოეული ელემენტის.
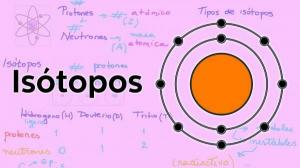
რა არის ატომური წონა და ატომური რიცხვი?
ეს რიცხვი წარმოადგენდა ატომის წონას და ეს იყო ერთადერთი გაზომვადი ღირებულება ატომები. ეს არ ყოფილა პირდაპირი გაზომვების ნებისმიერ შემთხვევაში (არ არსებობს საზომი ხელსაწყოები, რომლებიც საშუალებას იძლევა იზოლირებული ატომების აწონვა) სტანდარტი, რომელშიც წყალბადის ატომს მიენიჭა თვითნებური მნიშვნელობა 1 და გამოითვლება დარჩენილი ელემენტების ატომური წონის მნიშვნელობა. ნიმუში.
პირველი გამოთვლები ატომური ნომერი ელემენტებს ატარებდა ინგლისელი ქიმიკოსი ჯონ დალტონიდა დიდი სამეცნიერო დებატები გამოიწვია XIX საუკუნის პირველ ნახევარში. ამასთან, მე -19 საუკუნის მეორე ნახევარში უკვე არსებობდა შესანიშნავი კონსენსუსი ელემენტთა ატომური წონის გამოთვლის სისტემის შესახებ. ატომური წონა გახდა მენდელეევიდან მოყოლებული, ძირითადი კრიტერიუმი პერიოდული სისტემის ელემენტების სწორად განლაგებისათვის.
როდესაც მენდელეევმა უბრძანა ცნობილი ელემენტები მათი მიხედვით ატომური წონის გაზრდა, დააკვირდა განმეორებადი თვისებების გამოვლენას, რაც საშუალებას აძლევს ელემენტებს დააჯგუფონ ელემენტების ჯგუფები ან ოჯახები, რომლებიც ერთმანეთის მსგავსია. ამასთან, ზოგიერთ შემთხვევაში, ელემენტების ატომური წონის მიხედვით დალაგება არ პასუხობდა დაფიქსირებულ ელემენტებს შორის მსგავსებას და მენდელეევმა შეიცვალა პერიოდული ცხრილის განლაგებაში 17 ელემენტის პოზიცია მათი ატომური წონის მიუხედავად, რათა შეძლონ მათი დაჯგუფება იმ ელემენტებთან, რომლებთანაც მათ ანალოგიები წარმოადგინეს.
ამ ცვლილებებმა ცხადყო, რომ ზოგიერთი მიღებული ატომური წონა არ იყო სწორი და გადაანგარიშდა. ატომურ წონებში შესწორებების მიუხედავად, მაინც არსებობდა ელემენტები, რომლებიც უნდა განთავსებულიყო სხვა პოზიციებში, გარდა მათი ატომური წონის მიხედვით.

სურათი: BBC.com
პერიოდული სისტემის ისტორია და ევოლუცია.
მენდელეევის უეჭველი წვლილის მიუხედავად, ელემენტთა პერიოდული სისტემა არ არის ერთი მკვლევარის მუშაობის შედეგი. მენდელეევის გარდა, მეცხრამეტე საუკუნის მეორე ნახევრის განმავლობაში და მთელი მეოცე საუკუნის განმავლობაში მრავალი ქიმიკოსებმა განაგრძეს ქიმიური ელემენტების შესახებ ინფორმაციის ორგანიზების საუკეთესო ხერხის გამოკვლევა ცნობილია მით უფრო, თუ გავითვალისწინებთ იმას, რომ ამ დროის განმავლობაში აღმოჩენა ახალი ქიმიური ელემენტები ან მარტივი ნივთიერებებისპექტრომეტრიის წყალობით (რომელიც სწავლობს ატომებსა და ელექტრომაგნიტურ გამოსხივებას შორის ურთიერთქმედებას).
ელემენტების კლასიფიკაცია პერიოდულ სისტემაში თავდაპირველად ეფუძნებოდა ატომური წონა ელემენტებისა და გამოვლენილი ანალოგიების საშუალებით, რომლებიც საშუალებას აძლევდა ელემენტებს ანალოგურ ოჯახებად დაეჯგუფებინათ. ასეც რომ იყოს, ამ პერიოდული თვისებების გამოვლენის მიზეზი ვერ აიხსნება. მე -20 საუკუნის განმავლობაში, ელექტრონული სტრუქტურის აღმოჩენისას, გააზრდა ელემენტების თვისებების ამ პერიოდულობის მიზეზი.
ატომური რიცხვი, როგორც დალაგების რიგი
მე -20 საუკუნის დასაწყისში გლოვერი და რეზერფორდი, დააკვირდა, რომ ბირთვში დამუხტული ნაწილაკები ატომური წონის დაახლოებით ნახევარს შეადგენს. ეს მნიშვნელობა შეესაბამება კონცეფციას ატომური ნომერი რომელიც განისაზღვრება როგორც ატომურ ბირთვში პროტონის რაოდენობა და რომელიც ემთხვევა ნეიტრალურ ატომში ელექტრონების რაოდენობას. ამ ახალმა ღირებულებამ გაამართლა გარკვეული ელემენტების პოზიციის ცვლილებები, რომლებიც მანამდე იყო განხორციელებული. მაგალითად პოზიციის შეცვლა ტელურიუმსა და იოდს შორის.
1913 წელს ჰენრი მოსელი დაადასტურა ცხრილის დალაგება, როგორც ატომური რიცხვის ფუნქცია რენტგენის სპექტრომეტრიით. ატომური რიცხვის მიხედვით შეკვეთა დღესაც ძალაშია.
ამავე დროს, მე -20 საუკუნის განმავლობაში, ახალი ქიმიური ელემენტების აღმოჩენა განაგრძო კვანტური მექანიკის და ტექნიკის შემუშავების წყალობით. ატომების დაბომბვა ნაწილაკებით, საუკუნის მეორე ნახევრიდან. ამ ახალი ტექნიკით შესაძლებელი იყო შექმნა ხელოვნური ელემენტები რომლებიც ბუნებაში არ არის.
მიუხედავად იმისა, რომ პერიოდულ სისტემაში მიღწეულია პროგრესი ელემენტების სწორად განლაგებაში გარკვეული თვისებების განმეორებითი წარმოშობის მიზეზი (თვისებები) პერიოდული). განვითარების კვანტური მექანიკა (ფიზიკის ფილიალი, რომელიც შეისწავლის სინათლისა და ატომების ქცევას მიკროსკოპული მასშტაბით) 1920 წლიდან იყო გადამწყვეტი ამ თვისებების მიზეზის ასახსნელად.
ელექტრონული კონფიგურაცია, როგორც პერიოდული თვისებების ახსნა
მე -20 საუკუნის პირველი ნახევრის განმავლობაში ფიზიკოსები ნილს ბორი ი ვოლფგანგ პაული მათ შემოგვთავაზეს ატომური მოდელი, რომელშიც ელექტრონებს მხოლოდ გარკვეული ორბიტების დაკავება შეუძლიათ და სადაც ელექტრონები განლაგებულია სხვადასხვა ენერგეტიკული დონის ფენებად. ელექტრონის განაწილების გზა ორბიტალებში სხვადასხვა გარსში ან ენერგიის დონეზე ცნობილია, როგორც ელექტრონული კონფიგურაცია.
ელექტრონების კონფიგურაციებში ელექტრონების განლაგების აღმოჩენა ფუნდამენტური იყო თვისებების პერიოდულობის გასაგებად. პერიოდული, რადგან დაფიქსირდა, რომ ეს თვისებები მჭიდრო კავშირშია ატომების ყველაზე გარე ელექტრონულ კონფიგურაციასთან ( ვალენსია).
რიგი, რომლითაც ელექტრონები ავსებენ ატომურ ორბიტალებს, დაადგინა 1930 წელს ფიზიკოსმა ერვინ მადელუნგმა, რომელმაც დაადგინა რიცხვითი წესი შევსების წესისთვის. ეს წესი ცნობილია როგორც მადელუნგის წესი და ეს არის ემპირიული წესი, რომლის ახსნა შეუძლებელია კვანტური მექანიკის საშუალებით.
შევსების თანმიმდევრობა მარტივია პერიოდული ცხრილის პირველი სამი რიგისთვის, მაგრამ მეოთხე რიგი, სადაც განლაგებულია გარდამავალი ელემენტები, შევსების ბრძანება გადის მთელი რიგით ცვლილებები. სულ 20 ანომალიური ნივთია, რომლებიც არ იცავს ამ წესს.
მაგიდის ევოლუცია დღესაც გრძელდება
2006 წელს თეორიული ქიმიკოსი ევგენ შავრზი მან მოახერხა მადელუნგის მმართველობის ანომალიების ახსნა იმის გათვალისწინებით, რომ ატომებს ენერგეტიკული დონის მიხედვით შეიძლება ჰქონდეთ სხვადასხვა ელექტრონული კონფიგურაცია. საშუალო გამოთვლისას, ელემენტების უმეტესობის ელექტრონული კონფიგურაცია შეესაბამება მადელუნგის წესს.
პერიოდული ცხრილი 21 – ე საუკუნეში დებატების საგანია, თუმცა მისი მოწყობა ან ელექტრონული კონფიგურაცია ელემენტები, კვლავ ძალაშია ამ რიგის და ასახვის ანომალიების განმარტება ელექტრონულ კონფიგურაციებში თეორია.
თუ გსურთ წაიკითხოთ სხვა მსგავსი სტატიები პერიოდული ცხრილი ევოლუცია - რეზიუმეგირჩევთ შეიყვანოთ ჩვენი კატეგორია ატომი.
ბიბლიოგრაფია
სხვადასხვა ავტორები. (2019)სპეციალური: პერიოდული სისტემა. კვლევა და მეცნიერება. ბარსელონა: სამეცნიერო პრესა S.A.