ქიმიური ბმების 10 ტიპი (განმარტებულია მაგალითებით)
ქიმიური ობლიგაციებია ძალები, რომლებიც ატომებს ატარებენ ერთად მოლეკულების ფორმირება. ატომებს შორის არსებობს სამი სახის ბმა:
- მეტალის ბმა.
- იონური კავშირი.
- კოვალენტური კავშირი: არაპოლარული, პოლარული, მარტივი, ორმაგი, სამმაგი, დათიური.
ამ ობლიგაციების წყალობით წარმოიქმნება ყველა ის ნაერთი, რაც ბუნებაში არსებობს. ასევე არსებობს ძალები, რომლებიც ატარებენ მოლეკულებს ერთად, ცნობილი როგორც intermolecular bonds, როგორიცაა:
- წყალბადის ბმები ან ხიდები.
- დიპოლ-დიპოლური ძალები.
შემდეგ, ჩვენ ავუხსნით თითოეულ ამ ბმულს.
| ქიმიური ბმის ტიპები | დამახასიათებელი | მაგალითები | |
|---|---|---|---|
| ლითონი | ლითონის იონები მოძრაობენ ელექტრონების ზღვაში. | მეტალის ელემენტები: ნატრიუმი, ბარიუმი, ვერცხლი, რკინა, სპილენძი. | |
| იონიური | ელექტრონების გადატანა ერთი ატომიდან მეორეზე. | ნატრიუმის ქლორიდი+კლ- | |
| კოვალენტური | არაპოლარული | ელექტრონები ორ ატომს შორის თანაბრად გაანაწილეთ. | მოლეკულური წყალბადის H-H ან H2 |
| პოლარული | ელექტრონებს არათანაბრად ანაწილებს ორ ატომს შორის. | წყლის მოლეკულა H2ან | |
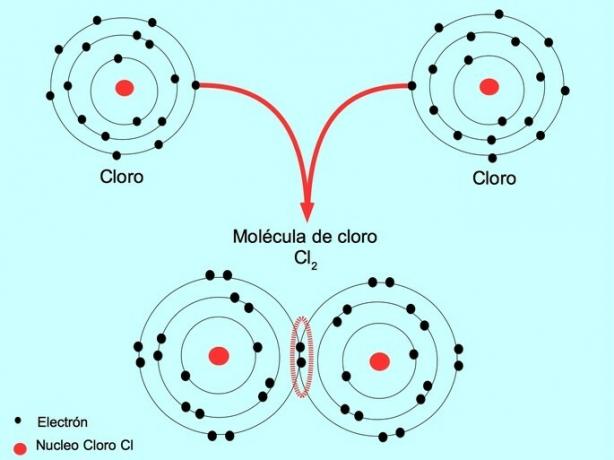
| მარტივი | გაუზიარეთ წყვილი ელექტრონი. | ქლორის მოლეკულა Cl2 Cl-Cl | |
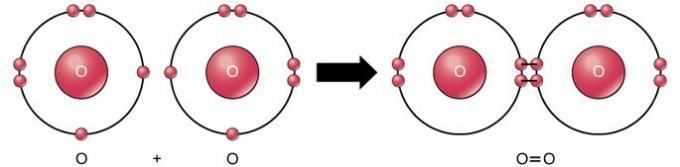
| Ორმაგი | გაუზიარეთ ორი წყვილი ელექტრონი. | ჟანგბადის მოლეკულა O2 O = O | |
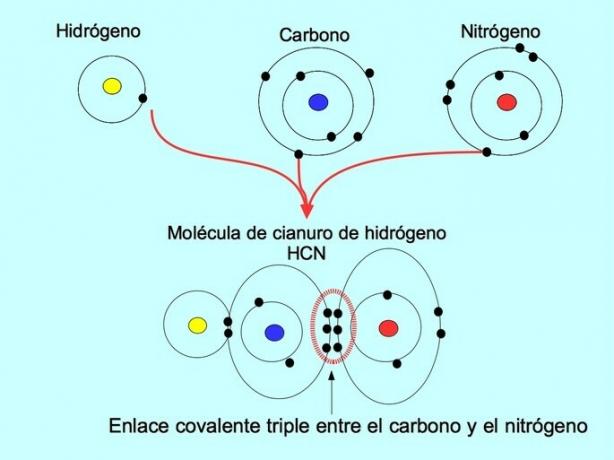
| სამმაგი | გააზიარეთ სამი წყვილი ელექტრონი. | აზოტის მოლეკულა N≣N ან N2 | |
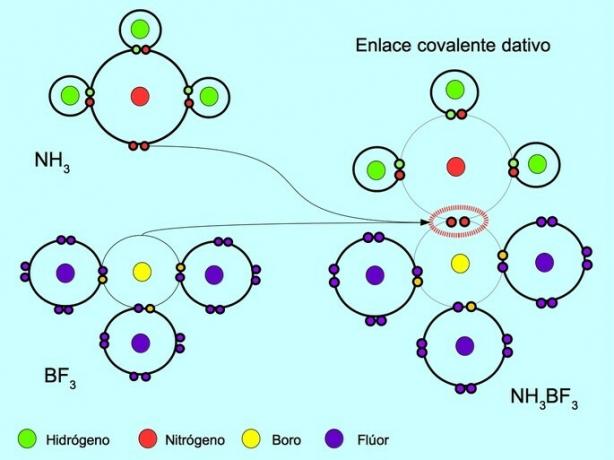
| დატიური | მხოლოდ ერთ ატომს აქვს ელექტრონები. | კავშირი აზოტსა და ბორს შორის არის ნაერთი ამიაკი-ბორის ტრიფტორიდის შემადგენლობაში. | |
| ინტერმოლეკულური ძალები | წყალბადის ხიდი | ერთ მოლეკულაში არსებული წყალბადები იზიდავს სხვა მოლეკულის ელექტრონეგატიულ ატომებს. | წყალბადის კავშირები წყალბადის შორის წყლის ერთ მოლეკულაში და ჟანგბადი წყლის სხვა მოლეკულაში. |
| დიპოლ-დიპოლი | ორი ელექტრული პოლუსის მქონე მოლეკულები იზიდავს სხვა მოლეკულების საპირისპირო პოლუსებს. | ურთიერთქმედება მეტალურ H მოლეკულებს შორის2C = O |
მეტალის ბმა
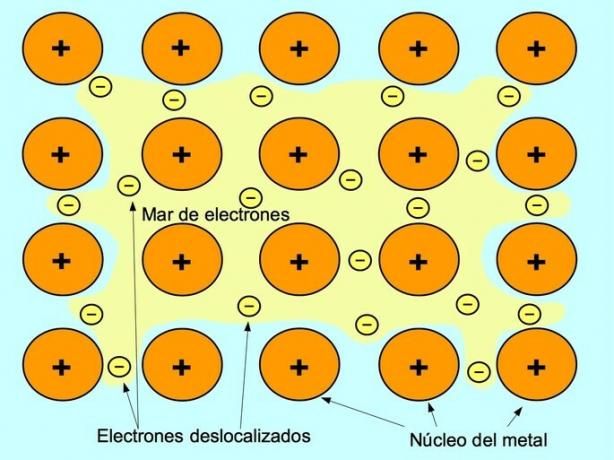
მეტალის ბმა არის მიზიდულობის ძალა მეტალის ელემენტების დადებით იონებსა და ნეგატიურ ელექტრონებს შორის, რომლებიც თავისუფლად მოძრაობენ იონებს შორის. ლითონის ატომები მჭიდროდ არის შეფუთული, ეს საშუალებას აძლევს ელექტრონებს გადაადგილდნენ ატომების ქსელში.
მეტალებში ვალენტური ელექტრონები გამოიყოფა თავდაპირველი ატომიდან და წარმოქმნის ელექტრონების "ზღვას", რომელიც მთელ მეტალის სტრუქტურაში მოძრაობს. ეს იწვევს ლითონის ატომების დადებითად დამუხტულ ლითონის იონებად გადაქცევას, რომლებიც ერთად იკრიბებიან.
ლითონის კავშირი დამყარებულია მეტალის ელემენტებს შორის, როგორიცაა ნატრიუმის Na, ბარიუმი Ba, კალციუმი Ca, მაგნიუმი Mg, ოქროს Au, ვერცხლის Ag და ალუმინის Al.
იონური კავშირი
იონური ბმა არის ძალა, რომელიც უერთდება მეტალის ელემენტს, მაგალითად, ნატრიუმს ან მაგნიუმს, არალითონურ ელემენტთან, როგორიცაა ქლორი ან გოგირდი. ლითონი კარგავს ელექტრონებს და გარდაიქმნება დადებით ლითონის იონად, რომელსაც ეწოდება კატიონი. ეს ელექტრონები გადადიან არალითონურ ელემენტამდე და ის გარდაიქმნება უარყოფითად დამუხტულ იონად, რომელსაც ეწოდება ანიონი.
კათიონები და ანიონები აერთიანებენ და ქმნიან სამგანზომილებიან ქსელს, რომელსაც ინარჩუნებენ იონებს შორის ელექტროსტატიკური მოზიდვის ძალები სხვადასხვა მუხტით. ეს ძალები ქმნიან იონურ ნაერთებს.
დედამიწის ქერქი ძირითადად იონური ნაერთებისგან შედგება. ქანების, მინერალებისა და ძვირფასი ქვების უმეტესობა იონური ნაერთებია. Მაგალითად:
- ნატრიუმის ქლორიდი NaCl: მეტალის ელემენტია ნატრიუმი, რომელიც ელექტრონს გადასცემს ქლორს, რომელიც არალითონური ელემენტია.
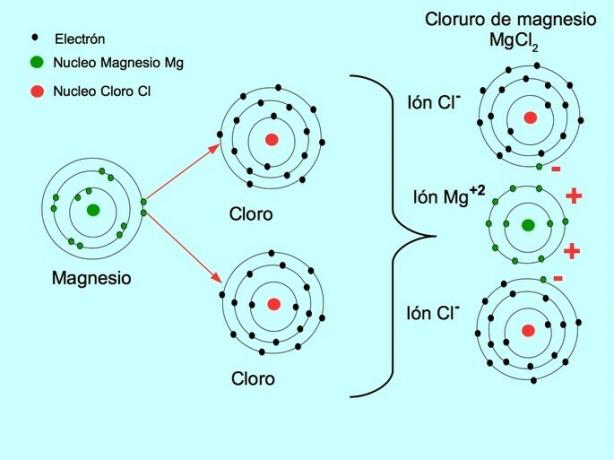
- მაგნიუმის ქლორიდი MgCl2მაგნიუმის მგ აჩუქებს ორ ელექტრონს ქლორის ორ ატომს, როგორც ეს ნაჩვენებია ქვემოთ მოცემულ ფიგურაში:
Იხილეთ ასევე განსხვავება კათიონებსა და ანიონებს შორის.
Კოვალენტური ბმა
კოვალენტური კავშირი წარმოიქმნება, როდესაც ორი არალითონური ატომი ელექტრონებს ანაწილებს. ეს კავშირი შეიძლება იყოს რამდენიმე ტიპი, რაც დამოკიდებულია ატომების ელექტრონების მიმართ დამოკიდებულებასა და გაზიარებული ელექტრონების რაოდენობაზე.
არაპოლარული კოვალენტური კავშირი
არაპოლარული კოვალენტური ბმა არის კავშირი, რომელიც იქმნება ორ ატომს შორის, სადაც ელექტრონები თანაბრად ნაწილდება. ეს კავშირი ჩვეულებრივ გვხვდება სიმეტრიულ მოლეკულებში, ანუ მოლეკულები, რომლებიც შედგება ორი თანაბარი ატომისგან, მაგალითად, წყალბადის მოლეკულა H2 და ჟანგბადის მოლეკულა O2.

პოლარული კოვალენტური კავშირი
პოლარული კოვალენტური კავშირი წარმოიქმნება მაშინ, როდესაც ორ ატომს ელექტრონები აქვთ, მაგრამ ერთ მათგანს უფრო მეტი მიზიდულობა აქვს ელექტრონებისთვის. ეს ქმნის მოლეკულას უფრო უარყოფითი "პოლუსის" მეტ ელექტრონს და საპირისპირო პოლუსი უფრო პოზიტიურია.
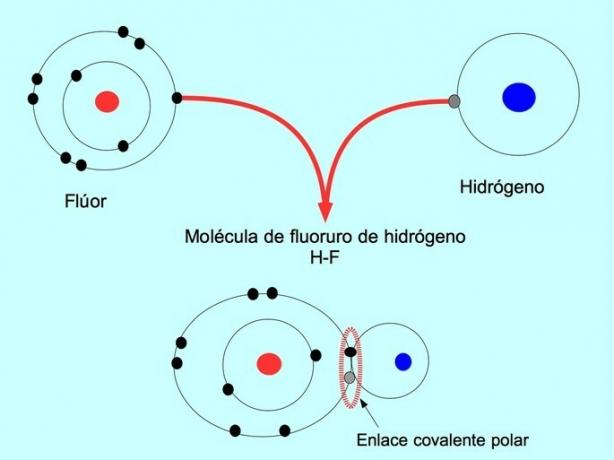
ელექტრონების ამ განაწილების ან დისბალანსის მქონე მოლეკულები ცნობილია როგორც პოლარული. მაგალითად, წყალბადის ფტორს HF– ში არსებობს კოვალენტური კავშირი წყალბადსა და ფტორს შორის, მაგრამ ფტორს აქვს უფრო მაღალი ელექტრონეგატივი, ამიტომ იგი ელექტრონებს უფრო ძლიერად იზიდავს გააზიარა.
მარტივი კოვალენტური ბმა
როდესაც ორ ატომს ორი ელექტრონი ეყოფა, თითოეულისგან თითო, წარმოქმნილ კოვალენტურ ბმას ერთ კოვალენტურ კავშირს უწოდებენ.
მაგალითად, ქლორი არის ატომი, რომელსაც გარე გარსში შვიდი ვალენტური ელექტრონი აქვს, რომელთა შევსება რვა ელექტრონითაც შეიძლება. ქლორი შეიძლება გაერთიანდეს სხვა ქლორთან და წარმოქმნას ქლორის მოლეკულა Cl2 რაც ბევრად უფრო სტაბილურია, ვიდრე მხოლოდ ქლორი.
ორმაგი კოვალენტური კავშირი
ორმაგი კოვალენტური კავშირი არის კავშირი, სადაც ოთხი ელექტრონი (ორი წყვილი) ელექტრონი ნაწილდება ორ ატომს შორის. მაგალითად, ჟანგბადს აქვს 6 ელექტრონი თავის ბოლო გარსში. ორი ჟანგბადის შერწყმისას, ოთხი ელექტრონი ნაწილდება ორს შორის, რის შედეგადაც თითოეულ გარსში 8 ელექტრონი უნდა იყოს.
სამმაგი კოვალენტური ბმა
სამმაგი კოვალენტური კავშირი წარმოიქმნება, როდესაც ორ ელექტრონულ ატომს შორის 6 ელექტრონი (ან სამი წყვილი) ნაწილდება. მაგალითად, წყალბადის ციანიდის მოლეკულაში HCN, წარმოიქმნება სამმაგი კავშირი ნახშირბადსა და აზოტს შორის, როგორც ეს მოცემულია ქვემოთ მოცემულ ფიგურაში:
საკოორდინაციო ან დენტალური კოვალენტური ბმა
კოორდინირებული ან დატორული კოვალენტური ბმა არის კავშირი, რომელიც წარმოიქმნება, როდესაც ობლიგაციის მხოლოდ ერთ ატომს აქვს ელექტრონული წყვილი. მაგალითად, როდესაც ამიაკი NH რეაგირებს3 ბორის ტრიფთორიდით BF3აზოტის კავშირი ორ ელექტრონთან არის უშუალოდ ბორისთან, რომელსაც ელექტრონები არ აქვს გასაზიარებლად. ამ გზით, ორივე აზოტს და ბორს რჩება 8 ელექტრონი თავიანთ ვალენტურ გარსში.
Იხილეთ ასევე ორგანული და არაორგანული ნაერთები.
ინტერმოლეკულური კავშირები
მოლეკულები ასოცირდება ძალების საშუალებით, რაც საშუალებას იძლევა თხევადი ან მყარი მდგომარეობის მქონე ნივთიერებების წარმოქმნა.
დიპოლ-დიპოლური ბმები ან ძალები
სუსტი ინტერმოლეკულური ბმები შეიძლება დამყარდეს პოლარულ მოლეკულებს შორის, როდესაც უარყოფითი პოლუსები იზიდავს პოზიტიურ პოლუსებს და პირიქით. მაგალითად, მეთანის H2C = O არის პოლარული მოლეკულა, ნაწილობრივი უარყოფითი მუხტი ჟანგბადზე და ნაწილობრივი დადებითი მუხტი წყალბადებზე. ერთი მეტალური მოლეკულის დადებითი მხარე იზიდავს სხვა მეტალური მოლეკულის უარყოფით მხარეს.
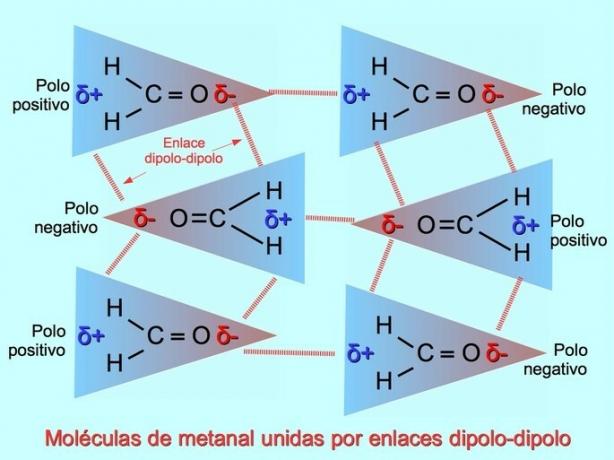
წყალბადის ობლიგაციები ან ობლიგაციები
წყალბადის კავშირი ან წყალბადის კავშირი არის კავშირი, რომელიც დამყარებულია მოლეკულებს შორის. ეს ხდება მაშინ, როდესაც მოლეკულაში წყალბადის კოვალენტურად უკავშირდება ჟანგბადს, აზოტს ან ფტორს. ჟანგბადი, აზოტი და ფტორი უფრო მაღალი ელექტრონეგატივის მქონე ატომები არიან, ამიტომ ისინი უფრო ძლიერად იზიდავენ ელექტრონებს, როდესაც ისინი მათ სხვა ნაკლებად ელექტრონეგატიურ ატომთან აქვთ.
წყლის მოლეკულებს H შორის არის წყალბადური ბმები2O და ამიაკი NH3 როგორც სურათი გვიჩვენებს:
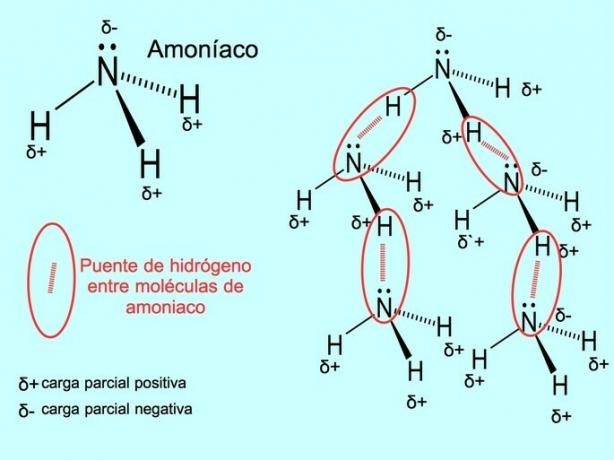
შეიძლება დაგაინტერესოთ ნახოთ:
- ატომები და მოლეკულები.
- ორგანული და არაორგანული ნაერთების მაგალითები.
- ლითონები და არამეტალები
გამოყენებული ლიტერატურა
ზუმდალი, ს.ს., ზუმდალი, ს.ა. (2014) ქიმია. მეცხრე გამოცემა. ბრუკსი / კოული. ბელმონტი.
Commons, C., Commons, P. (2016) ჰაინემანის ქიმია 1. მე -5 გამოცემა. პირსონი ავსტრალია. მელბურნი.