흡열 반응과 발열 반응의 차이점
ㅏ 흡열 반응 동안 전원이 필요합니다 발열 반응 에너지를 방출합니다. 화학 반응의 이러한 분류는 반응물 또는 생성물로서의 에너지 참여를 고려합니다.
에너지는 일을 하거나 열을 생산하는 능력입니다. 화학 반응은 파손되거나 화학 결합이 형성되는 물질 사이의 원자 재구성을 포함한다는 것을 기억하십시오. 일반적으로 이러한 화학 결합의 형성 또는 파괴는 시스템 에너지의 변화를 동반합니다.
| 흡열 반응 | 발열 반응 | |
|---|---|---|
| 정의 | 에너지가 흡수되는 화학 반응. | 에너지가 열의 형태로 방출되는 화학 반응. |
| 에너지의 기원 | 환경의 | 시스템의 |
| 잠재력 | 제품보다 반응물이 적습니다. | 제품보다 반응물에서 더 높습니다. |
| 생산 | 자발적이지 않음 | 자발적인 |
| 내부 에너지 변화 | ΔE> 0; 0보다 큰 내부 에너지 변화. | ΔE <0; 내부 에너지 변화는 0보다 작습니다. |
| 온도 | 감소 | 증가 |
| 예 | 광합성 및 합성의 일반적인 반응. | 불타는 성냥, 연소 반응. |
흡열 반응이란 무엇입니까?
화학 반응은 다음과 같을 때 흡열 반응입니다. 환경에서 에너지를 흡수. 이 경우 열은 외부에서 시스템 내부로 전달됩니다. 흡열 반응이 일어나는 동안 온도계를 놓으면 온도가 떨어집니다.
"endothermic"이라는 단어는 그리스어에서 파생됩니다. 엔돈 "내부"를 의미하고 테마 "열"을 의미합니다. 흡열 반응은 자발적으로 진행되지 않습니다.
흡열 반응에서 에너지는 어디에서 오는가?
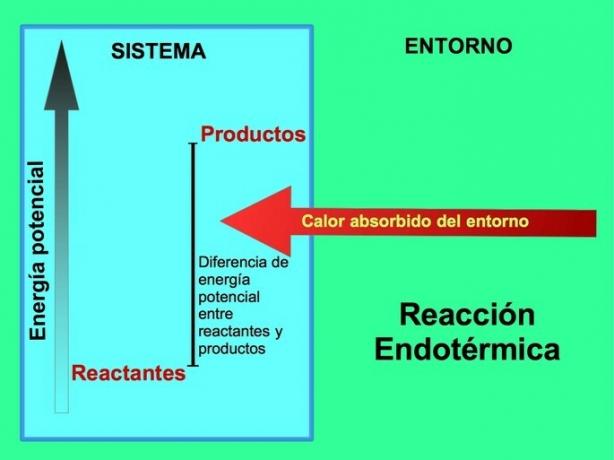
흡열 반응에서 에너지는 시스템 외부의 환경에서 옵니다. 생성물의 위치 에너지의 양은 반응물의 위치 에너지보다 큽니다. 따라서 반응이 진행되기 위해서는 반응물에 에너지를 추가해야 합니다. 이 에너지는 환경의 열에서 나옵니다.
예를 들어, 광합성은 흡열 과정이다, 여기서 식물은 이산화탄소와 산소로부터 포도당을 생산하기 위해 태양 에너지를 포착합니다.

광합성 반응의 생성물인 포도당과 산소는 반응물인 이산화탄소와 물에 비해 더 많은 양의 위치 에너지를 갖는다. 에너지 사용량에 따른 흡열 화학 반응의 다른 예:

흡열 반응의 예
반응이 일어나는 것은 화학 실험실에서만 일어나는 것이 아닙니다. 우리는 일상적으로 흡열 반응이 일어나는 상황도 찾습니다.
음식을 요리하다
별 것 아닌 것 같아도 음식을 조리하는 과정은 흡열적이다. 특정 음식을 섭취하려면 열을 공급해야 합니다.
인스턴트 콜드백
요철이나 염좌를 치료하는 데 사용하는 냉찜질은 물로 채워져 있지만 흔들거나 두드리면 질산암모늄이 함유된 캡슐이 내부에서 깨집니다. 질산암모늄을 물과 혼합하는 것은 흡열 반응으로 백이 냉각됩니다.
당신은보고 관심이있을 수 있습니다 열과 온도의 차이.
발열반응이란?
ㅏ 발열 반응은 시스템에서 에너지가 흐르는 반응입니다.. 이 에너지는 열의 형태로 방출되므로 반응 시스템에 온도계를 배치하면 온도가 상승합니다.
"발열성"이라는 단어는 엑소 "외부"를 의미하고 테마, "열"을 의미합니다. 발열 반응은 자발적으로 발생할 수 있으며 경우에 따라 알칼리 금속과 물의 조합과 같이 폭발적입니다.
발열 반응에서 에너지는 어디에서 오는가?
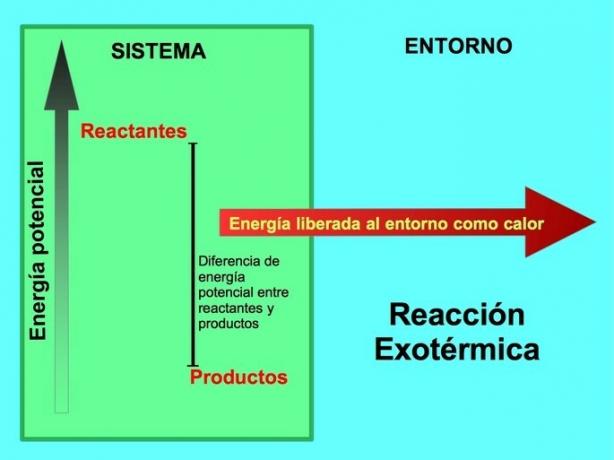
화학 반응에서 반응물은 변형되어 생성물을 생성하는 화합물입니다. 예를 들어, Na 나트륨이 염소 Cl과 반응할 때, 이들은 반응물이고 생성물은 염화나트륨 NaCl입니다.

반응물과 생성물 모두 위치 에너지를 저장했습니다. 우리는 l에서 안다에너지 절약 ey 에너지는 손실도 얻지도 않으므로 반응물의 에너지는 생성물의 에너지와 같아야 합니다.
발열 반응에서 l반응물은 제품에 비해 더 많은 위치 에너지를 가지고 있습니다., 따라서 초과 에너지는 열로 방출됩니다. 이 경우 에너지도 제품의 일부로 간주됩니다.

모든 발열 과정에서 화학 결합에 저장된 위치 에너지의 일부는 열을 통해 열 에너지로 변환됩니다.
발열 반응의 예
세탁 세제
손에 약간의 세척 가루를 물에 녹이면 약간의 열이 나는 것을 느낄 수 있습니다.
가정용 가스 연소
메탄이나 부탄과 같은 가정용 가스의 연소는 산소와 화학 반응을 일으켜 이산화탄소와 물을 형성하고 에너지를 방출합니다. 이것은 일상적인 사용에서 일반적인 발열 반응입니다.
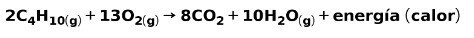
연소 과정에서 방출되는 에너지는 음식을 요리하는 데 사용됩니다.
당신은 또한 그들이 무엇인지에 관심이있을 수 있습니다 개방형 시스템, 폐쇄형 시스템 및 격리된 시스템.



