산과 염기의 특성: 주요 차이점
산과 염기의 특성은 우리가 산과 염기를 구별할 수 있는 모든 성질과 성질입니다.
아레니우스의 이론에 따르면, 산 양성자 H를 방출하는 물질입니다.+ 물에 녹일 때, 그리고 베이스 하이드록실 이온을 방출하는 모든 물질 OH- 수용액에 있을 때.
| 산 | 기지 | |
|---|---|---|
| 이온 형성 | 선물 | 선물 |
| 중화 반응 | 염기와 반응할 때. | 산과 반응할 때. |
| 수용성 | 녹는 | 부분적으로 용해됨. 칼슘, 바륨 및 알루미늄 수산화물은 잘 녹지 않습니다. |
| 전기 전도도 | 선물 | 선물 |
| 물질의 상태 | 고체, 액체 또는 기체 | 고체, 액체 또는 기체 |
| 리트머스 종이와의 반응 | 붉은 착색 | 블루 컬러링 |
| PH 값 | 7세 미만 | 7 이상 |
| 켤레 대응물 | 약산은 짝염기를 형성합니다. | 약한 염기는 공액산을 형성합니다. |
| 부식 효과 | 강산 | 강한 염기 |
산의 특성
산에는 식별할 수 있는 몇 가지 특성이 있습니다.
산에서 이온을 형성하는 능력
산성 물질의 주요 특징은 이온화될 수 있다는 것, 즉 전자를 잃거나 얻을 수 있다는 것입니다.
강산인 염산 HCl은 이온화되어 염화물 음이온 Cl을 형성합니다.- 및 양성자 H+.
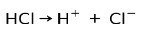
중화 반응
산은 염기와 반응하여 염과 물을 형성합니다. 이 반응은 다음과 같이 알려져 있습니다. 중화 반응. 예를 들어, HCl은 NaOH와 반응하여 염화나트륨 NaCl(식염)과 물을 형성합니다.
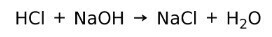
산의 수용성
산은 일반적으로 물에 용해됩니다. 예를 들어, 염산 또는 muriatic acid는 물에 적당히 용해되며 0ºC에서 최대 82g의 HCl을 100ml의 물에 용해할 수 있습니다. 황산 H의 경우2SW4, 물과 혼합하면 열이 발생하므로 폭발을 방지하기 위해 항상 산을 물에 첨가하는 것이 좋습니다.
산 강도
산이 어떻게 해리되는지에 따라 강한지 약한지 결정됩니다. 산의 강도는 해리 상수.
질산 HNO3 그것은 강산 수용액에서는 양성자와 질산염 이온으로 완전히 이온화되기 때문입니다.

이것은 우리가 HNO를 추가할 때3 물에서 물을 분석할 때 H만 찾을 수 있습니다.+ 및 질산염 이온, 거의 HNO 없음3.
대신 식초에서 발견되는 아세트산은 약산, 그것의 일부만 분리되어 있기 때문에:
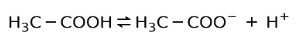
이것이 양방향 화살표로 표시되는 이유입니다. 이것은 수용액에서 아세트산, H가 있음을 의미합니다.+ 및 아세테이트 음이온(H3C-COO-).
산 물질의 상태
산은 액체, 고체 또는 기체 상태에서 찾을 수 있습니다. 예를 들어 염산 HCl은 액체이고 황화수소 HS는 기체이며 옥살산은 고체입니다.
산에서 리트머스 종이와의 반응

리트머스 종이를 산성 물질에 넣으면 리트머스 종이가 붉게 변합니다.
pH에 따른 산 식별
PH는 H의 양을 측정한 것입니다.+ 솔루션에 존재합니다. 따라서 pH 0과 7 사이에서는 산이 존재합니다. 예를 들어 식초의 pH는 2이고 자동차 배터리의 황산 pH는 1입니다.
산의 전기 전도도
산은 해리되어 전하를 띤 이온을 생성할 수 있기 때문에 산성 용액은 전기를 전도할 수 있습니다. 예를 들어, 자동차 배터리 내부에는 강산인 황산이 전기 전도체로 사용됩니다.
강산의 부식 효과
강산은 부식 효과가 있으며 유기 조직을 태울 수 있으므로 취급에 매우 주의해야 합니다.
약산은 접합된 대응물을 형성합니다.
용해될 때 약산은 짝염기(conjugate pair)로 알려진 것을 형성합니다. 즉, 약산은 짝염기를 형성합니다.
예:

이 경우, 포름산 또는 메탄산(HCOOH)은 해리될 때 공액 염기 이온 형식을 형성합니다.
관심을 가질 수 있습니다.
- 강산과 약산과 염기.
- 산과 염기의 예.
베이스의 특성
다음으로 우리는 그것들을 특징짓는 염기 또는 알칼리 용액의 특성을 제시합니다.
염기 이온화 용량
염기성 또는 알칼리성 물질은 물에 용해될 때 이온을 형성하는 특징이 있습니다.

이 경우 수산화나트륨 NaOH는 이온화되어 수산화 음이온 OH를 형성합니다.- 및 나트륨 양이온 Na+.
염기는 산과 반응하여 염을 형성
염기는 중화 반응에서 산과 반응하여 물과 염을 형성합니다. 예를 들면 다음과 같습니다.

이 경우 수산화알루미늄 Al(OH)3, 염기는 HCl과 반응하여 염화알루미늄염 AlCl을 형성한다.3 그리고 물. 수산화알루미늄은 위에서 생성된 산을 중화시켜 위산 역류를 완화시키는 제산제로 사용됩니다.
염기 수용성
일부 염기는 물에 용해됩니다. 수산화칼슘 및 수산화바륨과 같은 알칼리 토류 수산화물은 물에 잘 녹지 않습니다. 예를 들어 수산화나트륨이나 가성소다는 20ºC의 물 100ml에 109g을 녹일 수 있습니다. 수산화마그네슘 또는 마그네시아 밀크(OH)2 물에 거의 녹지 않습니다.
기본 강도
염기의 이온화 정도에 따라 강하거나 약할 수 있습니다. 예를 들어 수산화리튬은 강력한 기반 수용액에서는 수산화 이온 OH와 리튬 Li 양이온으로 완전히 이온화되기 때문입니다.+:
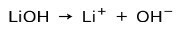
한편, 암모니아 NH3 이다 약한 기반 물과 접촉할 때 모든 암모니아가 해리되는 것은 아니기 때문입니다.
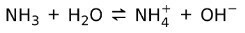
기지의 상태
염기는 고체, 액체 및 기체 상태에서 찾을 수 있습니다. 예를 들어 순수한 수산화나트륨은 고체이고 암모니아는 기체입니다.
염기의 리트머스 종이와의 반응
알칼리성 물질에 리트머스 종이 조각을 넣으면 종이가 파란색으로 변합니다.
pH에 의한 염기 식별
염기는 pH가 7에서 14 사이인 것이 특징입니다.
 베이스의 전기 전도도
베이스의 전기 전도도
이온화 능력으로 인해 염기는 우수한 전기 전도체입니다. 예를 들어, 알카라인 배터리에서는 수산화칼륨 KOH가 전기 전도체로 사용됩니다.
염기의 부식 효과
강한 염기는 유기 조직을 손상시킬 수 있습니다. 예를 들어, 주방 오븐 세척제는 일반적으로 강한 염기성이므로 항상 장갑과 보안경을 착용하고 극도의 주의를 기울여 취급하는 것이 좋습니다.
약한 염기는 켤레 대응물을 형성합니다.
약염기는 용해될 때 공액 대응물을 형성합니다. 즉, 약염기는 공액산을 형성합니다.
예를 들어, 트리스-(히드록시메틸)아미노메탄(OHCH2)3CNH2 공액산이 (OHCH)인 약염기이다.2)3CNH3+:
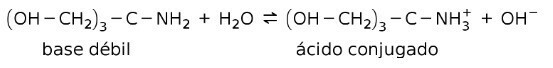
이것은 완충 물질 또는 완충기, 용액의 pH를 일정하게 유지하기 위해 사용되는 물질입니다.
다음의 차이점에 관심이 있을 수 있습니다.
- 산과 염기.
- 양이온과 음이온



