10 veidu ķīmiskie elementi (izskaidroti un klasificēti)
Cik daudz ķīmisko elementu ir jābūt Visumā? Šim jautājumam vēl ir tāls ceļš ejams, jo zinātnieki laiku pa laikam rada savus mākslīgos ķīmiskos elementus.
Tomēr mēs varam atbildēt uz to cik daudz ķīmisko elementu jābūt, kaut ko mēs uzzināsim tālāk.
- Saistīts raksts: "11 veidu ķīmiskās reakcijas"
Ķīmisko elementu veidi
Dabā mēs varam atrast visu veidu vielas. Šīs vielas parasti nav atrodamas tīrā stāvoklī, bet ir dažādu vielu kombinācijas rezultāts elementi vai materiāli, kas dažādu reakciju, procesu un laika periodu dēļ ir izraisījuši visa veida jautājums. Visumā nav nekā tāda, kas nebūtu dažādu veidu ķīmisko elementu atomu kombinācijas rezultāts, ko mēs redzēsim padziļināti.
Tomēr, pirms aplūkot ķīmisko elementu veidus, pārskatīsim vidusskolas zinātni un atcerēsimies, kas ir ķīmiskie elementi.
Mēs saucam par "ķīmisko elementu" matēriju, kas sastāv no viena veida atoma, tas ir, vielas, kas ir atomiski tīra. Ķīmiskos elementus nevar sadalīt vienkāršākos, un tos klasificē periodiskajā tabulā elementi kā tīri Visuma materiāli.
Bet uzmanieties! Mēs nedrīkstam jaukt elementus ar vienkāršām vielām, jo dažos gadījumos var sastāvēt divi vai vairāki viena un tā paša elementa atomi molekulas, kas sagrupētas dažādos veidos, kas izraisa dažu attiecīgā elementa fizisko īpašību atšķirības, piemēram, izotopi. Piemēram, dimants un ogleklis ir vielas, kas izgatavotas no ķīmiskā elementa oglekļa (C). bet tas tiek organizēts dažādos veidos, un tā rezultātā tiek iegūti divi pilnīgi atšķirīgi materiāli.
Kārlis sagāns Tajā bija teikts, ka mēs esam zvaigžņu putekļi, kas atspoguļo zvaigznes. Šī skaistā frāze nav tikai metafora, bet gan zinātnisks fakts. Ķīmiskie elementi, cik mēs zinām, veidojas zvaigžņu iekšienē kompleksa rezultātā kodolsintēzes un atomu skaldīšanas procesos, kas rada arvien smagākus elementus, kas ir procesa rezultāts nukleosintēze.
Lielāko daļu zināmo elementu var iegūt dabā, kas atrasti spontāni vai veidojot savienojumus ar citiem elementiem, piemēram, urānu (U), oglekli (C), silīciju (Si), sudrabu (Ag) vai zeltu (Au). No otras puses, citi ir ražoti laboratorijās, piemēram, americium (Am), berkelium (Bk) vai curium (Cm). Neatkarīgi no tā iegūšanas metodes vai dabā, atkarībā no tā īpašībām, attiecīgajam ķīmiskajam elementam būs daži vai citi pielietojumi.
Pašlaik ir zināmi aptuveni 118 ķīmiskie elementi, lai gan, ņemot vērā to, ka cilvēki ir spējuši ražot jaunus elementus, ir laika jautājums, līdz periodiskā tabula paplašinās.
- Jūs varētu interesēt: "2 elektrības veidi (paskaidrots)"
Galvenie ķīmisko elementu veidi
Galvenie ķīmisko elementu veidi ir attēloti periodiskajā tabulā gadā izveidoja krievu ķīmiķa Dmitrija Mendeļejeva (1834-1907) klasifikāciju 1869. Ķīmiskie elementi tiek vizuāli sakārtoti, pamatojoties uz to īpašībām un īpašībām.
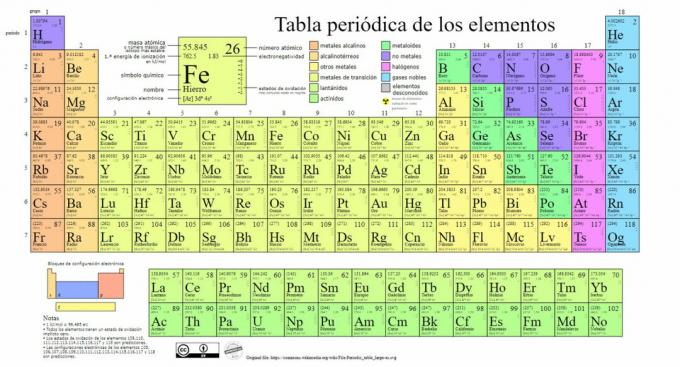
Laika gaitā un tā kā ķīmija veica nozīmīgus zinātniskus atklājumus, šī tabula tiks paplašināta pēc kārtas, sasniedzot tādu formu, kāda tā ir šodien ar 118 līdz šim zināmajiem elementiem.
Šobrīd šajā tabulā mēs varam atrast šāda veida ķīmiskos elementus:
1. Metāli
Metāli ir ķīmiskie elementi, kuru atoma pēdējā orbītā parasti ir no viena līdz trim elektroniem, elektroni, kurus var viegli pārnest padarot tos par siltuma un elektrības vadītājiem.
Metāli parasti ir kaļami un kaļami, ar raksturīgu spīdumu, kura intensitāte ir atkarīga no to atomu veidojošo elektronu kustības. Lielākoties metāli istabas temperatūrā ir cieti, izņemot dzīvsudrabu.
Starp metāliem mēs atrodam zeltu (Au), sudrabu (Ag), varu (Cu) un alumīniju (Al), kuru fiziskās īpašības padara tos par lieliskiem elektrības vadītājiem, lai gan to klātbūtne dabā ir ļoti dažāda, atspoguļojas atšķirībā starp to svaru.
Tiek uzskatīts, ka 75% dabā esošo ķīmisko elementu ir metāli, bet atlikušos 25% veidotu cēlgāzes, metalloīdi un citi veidi.
Šajā kategorijā ir klasifikācijas, kurās atrodami aktinīdi, lantanīdi, pārejas metāli, sārmu metāli, sārmzemju metāli un citi metāli.
- Saistīts raksts: "10 pārtikas produkti ar augstu cinka saturu"
1.1. Lantanīdi
Lantanīda elementi ir atrodami nogulumos, kas sastāv no daudziem minerāliem. Tie ir balti metāli, kas viegli oksidējas saskarē ar gaisu. Starp tiem mēs atrodam Lantānu (La), Prometiju (Pm), Eiropiju (Eu) un Ytterbium (Yb).

- Jūs varētu interesēt: "5 ķīmisko saišu veidi: tā tiek veidota matērija"
1.2. Aktinīdi
Visi aktinīdu izotopi ir radioaktīvi. Starp tiem mēs atrodam aktīniju (Ac), urānu (U), plutoniju (Pu) un einšteinu (Es).
1.3. Pārejas metāli
Pārejas metāli atrodas periodiskās sistēmas centrālajā daļā. Tās galvenā iezīme ir tā ir elektroniska "d" orbītas konfigurācija, kas daļēji piepildīta ar elektroniem.
Šajā grupā ir visu veidu vielas, un saskaņā ar tās visplašāko klasifikāciju tas atbilstu ķīmiskajiem elementiem no 21 līdz 30, no 39 līdz 48, no 71 līdz 80 un no 103 līdz 112, kopā četrdesmit, un starp tiem mēs atradīsim vanādiju (V), rutēniju (Ru), sudrabu (Ag), tantala (Ta) un Lawrencio (Lr).

1.4. Sārmu metāli
Sārmu metāli ir sešu elementu grupa, kas sastāv no litija (Li), nātrija (Na), kālija (K), rubīdija (Rb), cēzija (Cs) un francija (Fr). Tie ir spīdīgi, mīksti metāli, ļoti reaģē normālā temperatūrā un spiedienā un viegli zaudē ārējo elektronu, kas atrodas orbītā.
1.5. Sārmainās zemes
Sārmzemju metāli ir elementu grupa, kurā mēs atrodam beriliju (Be), magniju (Mg), kalciju (Ca), stronciju (Sr), bāriju (Ba) un rādiju (Ra). Tās nosaukums cēlies no nosaukuma, kas dots tā oksīdiem, "zemēm", kurām piemīt pamata vai sārmainas īpašības.
Sārmainās zemes tie ir cietāki nekā sārmaini, spīd un ir labi elektriskie vadītāji. Tie ir mazāk reaģējoši nekā sārmaini un darbojas kā labi reducētāji. Viņiem ir spēja veidot jonu savienojumus, un tiem visiem ir divi elektroni ārējā apvalkā.

1.6. Citi metāli
Kategorija "citi metāli" ir vielu veids, kas šeit atrodams, jo jūs īsti nezināt, kur tās ievietot.
Tie ir metāla elementi, kas atrodas periodiskajā tabulā kopā ar metalloīdiem p bloka ietvaros. Tie mēdz būt mīksti ar zemu kušanas temperatūru. Starp tiem ir alumīnijs (Al), indijs (In), alva (Sn) un bismuts (Bi).

2. Nav metālu
Nemetāliem parasti ir no pieciem līdz septiņiem elektroniem pēdējā orbītā, kas ir īpašība ka viņi iegūst elektronus, nevis atsakās no tiem, un tādējādi viņiem izdodas iegūt astoņus elektronus, kas tādējādi stabilizē tos kā atomi.
Šie elementi tie ir ļoti slikti siltuma un elektrības vadītāji. Turklāt tiem nav raksturīga spīduma, tie nav ļoti kaļami, nav ļoti elastīgi un cietā stāvoklī ir ļoti trausli. Atšķirībā no metāliem tos nevar velmēt vai izstiept.
Tie galvenokārt ir nepieciešami bioloģiskām sistēmām, jo tie atrodas organiskie savienojumi, piemēram, sērs (S), ogleklis (C), skābeklis (O), ūdeņradis (H) un jods (I).

- Saistīts raksts: "20 dārgakmeņu veidi (aprakstīti un ar attēliem)"
3. Metalloīdi
Kā norāda viņu nosaukums, metalloīdi ir starpposma klasifikācija starp metāliem un nemetāliem, kam ir abu grupu īpašības. Tas ir saistīts ar faktu, ka to pēdējā orbītā ir četri atomi, kas ir starpposms metālu un nemetālu atomiem.
Šie ķīmiskie elementi vada elektrību tikai vienā virzienā, neļaujot to darīt pretējā virzienā kā metālos. Piemērs tam ir silīcijs (Si) - metaloīds, ko, pateicoties šim īpašumam, izmanto pusvadītāju elementu ražošanai elektronikas rūpniecībai.
Citi metaloīdi ir: bors (B), arsēns (As), antimons (Sb) un polonijs (Po).

4. Halogēni
Halogēni ir sešu elementu grupa, kas tiem ir tendence veidot molekulas, kas sastāv no diviem atomiem (diatomiskiem), kas ir ļoti ķīmiski aktīvi to elektronegativitātes dēļ.
Šīs vielas parasti parādās jonu veidā, tas ir, elektriski lādētas molekulas, kas šajā gadījumā ir mononegatīvas, ļoti oksidējošas. Tas nozīmē, ka halogēni ir kodīgas un kodīgas vielas.
Halogēni ir: fluors (F), hlors (Cl), broms (Br), jods (I), astāts (At) un tenīds (Ts).

5. Cēlgāzes
Cēlgāzes ir septiņu cilvēku grupa, kuras dabiskais stāvoklis ir gāzveida. Tās parasti parādās diatomisku molekulu veidā ar ļoti zemu reaktivitāti, tas ir, tās nereaģē ar citiem elementiem, kas veido citas vielas un šī paša iemesla dēļ tās ir pazīstamas kā inertas gāzes. Tas ir tāpēc, ka pēdējā orbītā šim līmenim ir maksimālais iespējamais elektronu skaits, kopā astoņi.
Šī atlasītā elementu grupa sastāv no hēlija (He), neona (Ne), argona (Ar), kriptona (Kr), ksenona (Xe), radona (Rn) un oganesona (Og), kas agrāk bija pazīstams kā ununokcijs.
