Kas ir ĶĪMISKĀS FORMULAS un kam tās ir paredzētas [KOPSAVILKUMS + VIDEOKLIPI]
Lai gan nešķiet, Periodiskās tabulas ķīmiskie elementi Viņi mūs ieskauj no visām pusēm. Tomēr daudzkārt tie nav atrodami atsevišķi, bet gan veido dažādu ķīmisko elementu molekulas vai makromolekulas. Ķīmiskās formulas ir šo savienojumu grafiskā izteiksme, un tās izmanto, lai standartizētu to nomenklatūru. Šajā SKOLOTĀJA nodarbībā mēs to redzēsim kas ir ķīmiskās formulas un kam tās paredzētas. Pievienojieties mums, lai uzzinātu vairāk!
The ķīmiskās formulas ir elementu grafiska izteiksme, kas veido ķīmiskie savienojumi.
Šīs ķīmiskās formulas nav patvaļīgas, bet tās atbilst dažām stingri noteikumi ķīmiskās nomenklatūras, ko nosaka IUPAC (Starptautiskā tīrās un lietišķās ķīmijas savienība).
Ķīmiskās formulas arī sniedz mums informāciju par elementi, kas veido molekulu, tā, piemēram, norāda katra atoma skaitu un attiecīgās proporcijas, kas to veido, un dažreiz pat veidu. Ķīmiskā saite kas pastāv starp šiem elementiem.
Katra eksistējošā molekula vai makromolekula atbilst tās ķīmiskajai formulai, lai arī kāda tā būtu
dažāda veida formulas. Katrs no šiem veidiem sniedz mums atšķirīgu informāciju par molekulu, taču tie visi palīdz mums izprast to ķīmiskā daba un tas palīdz mums saprast, kas notiek ķīmiskajās reakcijās un kā viens savienojums var pārveidoties par citiem.Bet, lai saprastu šo ķīmisko vielu nomenklatūru, ir jābūt zināmām zināšanām ķīmijā, jo tās pakļaujas diezgan specializētai tehniskajai valodai.

Attēls: slideplayer
The ķīmiskās formulas tos pārstāv ķīmisko simbolu savienība, ar katra atoma atbilstošo burtu, kāds tas ir periodiskā tabula, un apakšindeksi, kas ir skaitļi, kas atspoguļo to daudzumu atomi molekulā
Ķīmijā (gan organiskajā, gan neorganiskajā) ir daži fragmenti vai savienojumi, kas uzrāda noteiktu atkārtošanos gan strukturālā, gan funkcionālā veidā, un tos identificē pēc nosaukumiem specifisks. Ja šiem fragmentiem ir brīvie elektroni, kas netiek dalīti, tos sauc par radikāļiem, un tie ir nestabili, ļoti reaģējoši savienojumi ar īsu pussabrukšanas periodu.
Radikāļu piemēri ir metilgrupas CH3, nitrātu grupas NO3, hidroksilgrupas OH- vai radikāls Cl-. Tomēr tās ir pazīstamas kā funkcionālās grupas, ja tās ir atomi vai atomu grupas, kas pievienotas ķēdei oglekļa dioksīds (ar dažādu oglekli) un kas ir atbildīgi par reaktivitāti un ķīmiskajām īpašībām molekulas.
Šīs grupas ir īpaši svarīgas organiskajā ķīmijā (cilvēka biomolekulas pamatā ir ogleklis un ūdeņradis). Daži funkcionālo grupu piemēri ir karbonilgrupa = C = O vai karboksilgrupa -COOH.

Attēls: Monogramas.com
Kā mēs teicām, ir vairāki ķīmisko formulu veidi. Katra no šīm formulām sniedz mums dažāda veida informāciju par molekulām, un tāpēc tā kalpo konkrētam mērķim, un neviena formula nav labāka vai sliktāka par citu vispārīgā izteiksmē.
Mēs izšķiram ķīmisko formulu klases:
Empīriskās formulas
Empīriskās formulas ir visvienkāršākās formulas, kas attēlo ķīmisko molekulu, dažkārt sakot, ka tās ir minimālās formulas. Šīs formulas atspoguļo katra elementa atomu proporciju molekulā, kas ir vienkāršota līdz veseliem skaitļiem, vienmēr mazākajiem. Šīs formulas piemērs ir CH3 (metilgrupa) ar trim ūdeņraža atomiem un vienu oglekļa atomu.
Tomēr šīs formulas dažkārt var radīt nepareizus priekšstatus par molekulas sastāvu. Tas notiek, ja formula nenorāda faktisko atomu skaitu molekulā, kā tas ir ar peroksīdu ūdeņradis, kura empīriskā formula ir HO, ja formulai jābūt H2O2 (divi ūdeņraža atomi un divi no skābeklis). Tādējādi tas notiek, izmantojot nomenklatūras konvenciju, jo abi apakšindeksi ir vienādi, tie ir vienkāršoti.
Tomēr dažus savienojumus var attēlot tikai ar empīriskām formulām, jo tos veido jonu tīkli. Tas notiek, piemēram, vārāmajā sālī vai nātrija hlorīdā, kas tiek attēlots kā NaCl, kas norāda, ka katram nātrijam ir hlors.
Molekulārās formulas
Šāda veida formulas ir diezgan vienkāršas, tās vienkārši izsaka kovalentajā molekulā esošo atomu veidu un katra to skaitu. Tās ir formulas, kas ķīmiskos elementus un skaitļus uzrāda lineārā veidā (apakšindeksi veidā. Šāda veida formulas piemērs ir, ja glikozi sauc par C6H12O6, kas izsaka šo glikozi. Glikozes molekula sastāv no sešiem oglekļa atomiem, divpadsmit ūdeņraža atomiem un sešiem no tiem skābeklis.
Molekulārās formulas tiek plaši izmantotas, dažkārt sakot, ka tās ir patiesās molekulu formulas. Daudzos gadījumos tie sakrīt ar empīriskajām formulām, piemēram, CO2.
Daļēji izstrādātas formulas
Daļēji izstrādātas formulas ir tādu formulu veids, kas līdzinās molekulārajām formulām, jo tās izsaka arī atomus, kas veido molekulu, un to skaitu, kā arī sniedz informāciju par ķīmiskajām saitēm (attēlotas ar līnijām starp atomiem) un saites veidu starp oglekļa atomiem, kas to veido (ja tās ir vienkāršas, dubultas vai trīskārši). Daļēji izstrādātā formula ir noderīga, lai identificētu molekulu veidojošos radikāļus un tās ķīmisko struktūru (saites starp oglekļa un ūdeņraža atomiem nav attēlotas).
Glikozes gadījumā tās daļēji izstrādātā formula ir CH2OH - CHOH - CHOH - CHOH -CHOH - CHO un kā redzams oglekļa, ūdeņraža un skābeklis ir tāds pats kā molekulārajā formulā (attiecīgi seši, divpadsmit un seši) un visas atsevišķas saites (glikozei ir tikai saites vienkārši). Tāpēc šī formula ir sarežģītāka formula nekā molekulārā formula.
Daļēji izstrādātas formulas dažreiz sauc par saīsinātām un, iespējams, ir visplašāk izmantotā formulu klase. izmanto, jo īpaši organiskajā ķīmijā, lai gan tie neļauj mums novērot molekulu reālo ģeometriju.
Izstrādāta formula
Izstrādātās formulas ir nedaudz sarežģītākas nekā daļēji izstrādātās. Šāda veida formulās saite un katra atoma atrašanās vieta molekulā ir attēlota Dekarta plaknē, līdz tiek attēlots viss savienojums.
Strukturālā formula
Strukturālā formula ir grafisks molekulas struktūras attēlojums telpā, sniedzot mums informāciju par atomu secību un sadalījumu telpā. Šajā formulā ir parādītas arī ķīmiskās saites, kas veido molekulu, un, ja tās ir vienas, dubultās vai trīskāršās. Tāpēc šī formula ir tā, kas sniedz mums visvairāk informācijas par molekulu.
Šāda veida formulas vairāk tiek izmantotas profesionālā līmenī ķīmijas pasaulē, jo tās ļauj daudz skaidrāk redzēt ķīmiskās reakcijas vai jaunu molekulu sintēzi.
Lūisa formulas
Tās ir sarežģītas, ļoti specifiskas un tehniskas formulas. Tās ir zināmas arī kā Lūisa diagrammas vai struktūras un ir līdzīgas izstrādātajām molekulu formulām, bet Turklāt ir norādīti elektroni, kurus atomi dala katrā ķīmiskajā saitē, kas mainās atkarībā no atomu valences iesaistīti.
Šajās formulās saites starp atomiem ir attēlotas ar līnijām (arī norādot, vai tās ir vienas, dubultas vai trīskāršas) vai ar punktu pāri. Vientuļie elektroni vai elektroni, kas nav dalīti saitē, ir attēloti ar punktiem ap atomu, kuram tā atbilst.

Attēls: Organiskā ķīmija
Rakstot formulas, dažreiz tiek izmantota atsauce uzoksidācijas numurs elementa (tas ir bieži sastopams jonu savienojumos). Tie ir pozitīvo un negatīvo skaitļu kopa kas saistīti ar katru elementu.
- Oksidācijas skaitļus var interpretēt kā elektronu skaits ka elements piedalās kovalentajā saitē vai pāriet jonu saitē.
- Kad oksidācijas zīme virs atoma ir negatīvs, nozīmē, ka šis elements uztver elektronus, un tam blakus esošais skaitlis ir notverto elektronu skaits. Tāpēc oksidācijas stāvoklis -1 nozīmē, ka elements uzņem vienu elektronu, -2, kas uztver divus utt.
- Kad oksidēšanās pazīme ir pozitīvs, atoms atsakās no elektrona, un skaitlis, kas pavada šo zīmi, ir atmesto elektronu skaits. Līdzīgi, oksidācijas stāvoklis +1 nozīmē, ka tas dod vienu elektronu, +2, ka tas dod divus, un tā tālāk.
Tas darbojas galvenokārt jonu savienojumi, kovalentajās saitēs, lai gan interpretācija ir līdzīga, tā nav vienāda, jo šīm saitēm ir kopīgi elektroni. Šajos savienojumos mēs runājam par vairāk elektronnegatīviem elementiem, kas velk vairāk elektroniskā pāra un atstāj negatīvāku lādiņu atkarībā no piesaistīto elektronu skaita. To var redzēt Lūisa formulas.
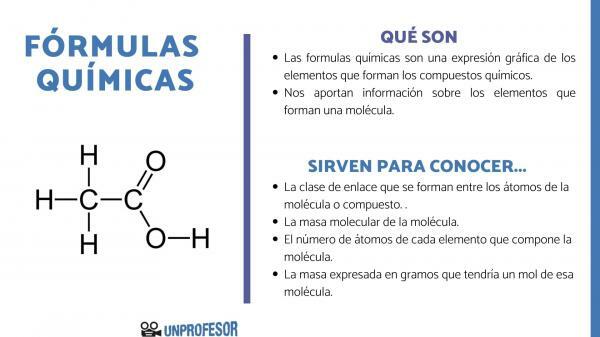
Ja vēlaties uzzināt, kam ir paredzētas ķīmiskās formulas, jums jāņem vērā, ka šis skaitlis ļauj mums iegūt dažas informācija par molekulām, kādi tie ir:
- The saites klase kas veidojas starp molekulas vai savienojuma atomiem. Šīs saites parasti ir kovalentas, ja tajās piedalās nemetāliski un jonu atomi, ja tās ir metāliskas un nemetāla saites.
- The molekulmasa no molekulas.
- The atomu skaits katra elementa, kas veido molekulu. To dažreiz sauc par molekulas simts lielumu.
- Masa, kas izteikta grami kam būtu viens mols šīs molekulas.
Attiecībā uz jonu savienojumu, piemēram, nātrija hlorīdu vai vārāmo sāli, tas nav stingri pareizi runāt par molekulām (lai gan dažreiz tas tiek darīts), ka tās mēdz veidot lielus agregātus un makromolekulas. Šajā gadījumā savienojuma formula palīdz mums redzēt, kuri joni to veido un kādā daudzumā.


